
科目:高中化学 来源: 题型:选择题
| A. | 上述反应属于分解反应 | |
| B. | 上述反应瞬间产生大量高温气体推动航天飞机飞行 | |
| C. | 反应从能量变化上说,主要是化学能转变为热能和动能 | |
| D. | 在反应中高氯酸铵只能起氧化剂作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 增大压强 | C. | 减小反应物浓度 | D. | 增大反应物浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4的稳定性高于SiH4,可推测CH4的沸点也高于SiH4 | |
| B. | 氯化钠的晶格能比氯化铯的晶格能小 | |
| C. | 根据价电子构型与化合价的关系,推出最外层电子数3个的元素一定是第ⅢA族元素 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出SO2通入NaClO溶液中能生成HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: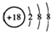 | |
| B. | 金刚石、石墨互称为同素异形体 | |
| C. | 光导纤维主要成分的化学式:Si | |
| D. | H216O、D216O、H218O、D218O互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、H2O都是非极性分子 | |
| B. | 氢键是一种特殊的化学键,它广泛地存在于自然界中 | |
| C. | 用价层电子对互斥理论预测H2S和BF3的立体结构,分别为V形、三角锥形 | |
| D. | 石英、食盐、金属钠、干冰的熔点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
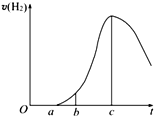 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com