
【题目】在一密闭容器中,当反应aA(g) ![]() bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
A. 平衡向正反应方向移动 B. a>b+c
C. 物质B的质量分数增大 D. 以上判断都错误
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】从宏观现象探究微观本质是重要的化学学科素养。
I. 以亚硫酸钠(Na2SO3)为实验对象,探究其性质。实验如下:
(资料1)亚硫酸(H2SO3)易分解生成SO2和H2O。
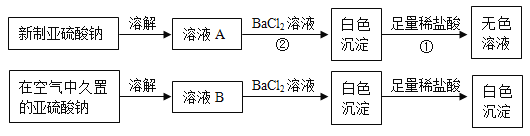
(1)写出上述实验中①、②的离子方程式_________________,_________________。
(2)通过上述实验可知,在空气中久置的亚硫酸钠固体中会混有_____________(填化学式),亚硫酸钠在空气中变质体现了亚硫酸钠的_________________性。
II. 以FeCl3溶液为实验对象,探究其与碱性物质之间反应的复杂多样性。实验如下:
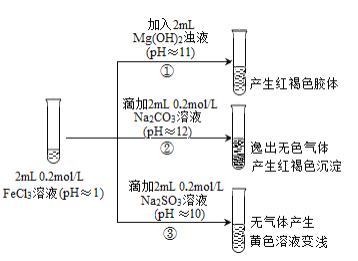
(资料2)含Fe3+的溶液中加入KSCN溶液,溶液由黄色变为红色;
含Fe2+的溶液中加入K3Fe(CN)6溶液,生成蓝色沉淀。
(1)①中反应的离子方程式是_____________________________。
(2)②中逸出的无色气体是_______________________________。
(3)对于③中的实验现象,同学们有诸多猜测,继续进行实验:
甲组:取③中反应后溶液少许,滴入稀盐酸酸化,再滴加BaCl2溶液,产生白色沉淀。得出结论:FeCl3与Na2SO3发生了氧化还原反应,离子方程式是_______________。
乙组:认为甲组的实验不严谨,重新设计并进行实验,证实了甲组的结论是正确的。其实验方案是_________。
(4)由上述实验可知,下列说法正确的是________(填字母)。
a. 盐与碱反应时,盐和碱都必须可溶于水
b. 盐溶液可能呈中性、碱性、酸性
c. 盐与盐反应时,不一定生成两种新盐
d. 盐与盐反应时,发生的不一定是复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;Ⅳ、Ⅴ、Ⅵ是气体收集装置,根据要求回答下列问题:
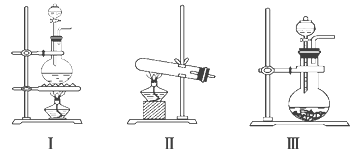
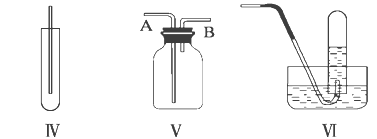
(1)若用MnO2与浓盐酸反应制取氯气,应选用发生装置_____,用方程式表示制取氯气的反应原理是______。
(2)若用KMnO4与浓盐酸反应制取氯气,试完成并配平下列离子方程式:
____MnO42-+____Cl-+____H+===____Mn2++____Cl2↑+____________。
(3)若选用Ⅳ为氯气的收集装置,应该在试管口放置一团棉花,该棉花团应用________溶液浸湿,其作用是____________。
(4)若选用Ⅴ为氯气收集装置,则氯气应从__________口通入。用化学方法检验氯气收集满了的方法是_______。
(5)科学家经研究发现NaClO2可用于制取自来水消毒剂ClO2。在一定条件下,将Cl2通入填充有固体NaClO2的反应柱内二者反应可制得ClO2。还原产物为_____,当消耗标准状况下1.12L Cl2 时,制得ClO2_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将SO2气体通入BaCl2溶液中,没有看到明显现象,再通入一种气体(或加入一种物质)后,可产生一种白色沉淀,该气体(或物质)不可能是( )
A.Cl2
B.NH3
C.CO2
D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.长期饮用纯净水有益于人体健康
B.长期服用阿司匹林可以预防某些疾病,没有副作用
C.纯天然物质都是绿色无毒的物质
D.长期食用花生油比猪油更有利于健康
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将稀氨水逐滴加入到稀盐酸中,当溶液的pH=7时,下列关系正确的是
A. c(NH4+) = c(Cl-) B. c(NH4+)=2c(Cl-)
C. 2c(NH4+)=c(Cl-) D. c(OH-)+c(Cl-) = c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组研究NaClO溶液与KI溶液的反应,实验记录如下:
实验编号 | 实验操作 | 实验现象 |
Ⅰ |
| ⅰ.溶液变为浅黄色 ⅱ.溶液变蓝 |
Ⅱ |
| ⅰ.溶液保持无色 ⅱ.溶液不变蓝,溶液的pH=10 |
【资料】:碘的化合物主要以I和IO3的形式存在。酸性条件下IO3不能氧化Cl,可以氧化I。ClO在pH<4并加热的条件下极不稳定。
(1)0.5 mol·L1 NaClO溶液的pH=11,用离子方程式表示其原因:______。
(2)实验Ⅰ中溶液变为浅黄色的离子方程式是______。
(3)对比实验Ⅰ和Ⅱ,研究实验Ⅱ反应后“溶液不变蓝”的原因。
① 提出假设a:I2在碱性溶液中不能存在。设计实验Ⅲ证实了假设a成立,实验Ⅲ的操作及现象是______。
② 进一步提出假设b:NaClO可将I2氧化为IO3。进行实验证实了假设b成立,装置如下图,其中甲溶液是______,实验现象是______。

(4)检验实验Ⅱ所得溶液中的IO3:
取实验Ⅱ所得溶液,滴加稀硫酸至过量,整个过程均未出现蓝色,一段时间后有黄绿色刺激性气味的气体产生,测得溶液的pH=2。再加入KI溶液,溶液变蓝,说明实验Ⅱ所得溶液中存在IO3。
① 产生的黄绿色气体是______。
② 有同学认为此实验不能说明实验Ⅱ所得溶液中存在IO3,理由是______。欲证明实验Ⅱ所得溶液中存在IO3,改进的实验方案是______。
③ 实验Ⅱ中反应的离子方程式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为碳酸氢钠片说明书的部分内容,据此判断该药品可用于( )
(药品名称)碳酸氢钠片
(成 分)碳酸氢钠NaHCO3
(功能主治)用于碱化尿液及酸血症,也可用于缓解胃酸过多引起的胃痛,胃灼烧感(烧心)反酸。
A.镇咳止痰B.抑酸止胃痛C.抗过敏D.抗菌消炎
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲中①②③④表示不同化学元素所组成的化合物,图乙表示由四个单体构成的化合物.以下说法不正确的是
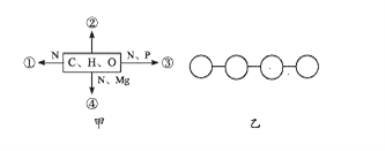
A. 若图甲中的②大量存在于皮下和内脏器官周围等部位,则②最可能是脂肪
B. 图甲中④可以表示叶绿素
C. 图乙中若单体是氨基酸,则该化合物彻底水解需要3分子水
D. 若③为多聚体,且能贮存生物的遗传信息,则③一定是DNA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com