
| Ⅰ |
| Ⅱ |
| Ⅲ |


科目:高中化学 来源: 题型:
| A、氯气通入KI溶液中:Cl2+2I-═2Cl-+I2 |
| B、氯气溶于水中:Cl2+H2O═H++Cl-+HClO |
| C、碳酸氢钠溶液与硝酸反应:HCO3-+H+═H2O+CO2↑ |
| D、氯化铁溶液中加入过量氨水:Fe3++3OH-═Fe(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
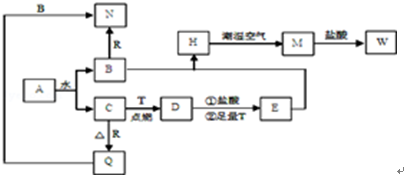
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、-283.01KJ/mol |
| B、+172.51 KJ/mol |
| C、+283.01KJ/mol |
| D、-504.01 KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
| B、设想把“H2+Cl2═2HCl”设计成燃料电池,用于工业制盐酸,并进行发电 |
| C、纯锌与稀硫酸反应产生氢气的速率较慢,再加入少量CuSO4固体,速率不变 |
| D、原电池的两极一定是由活泼性不同的两种金属组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
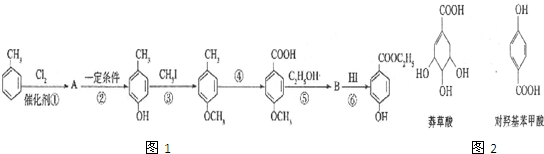
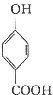 生成C7H5O3Na的化学反应方程式
生成C7H5O3Na的化学反应方程式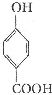 所有同分异构体的结构简式
所有同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
A、 是世界通用的循环再生标志,简称回收标志 是世界通用的循环再生标志,简称回收标志 |
| B、含有食品添加剂的食品对人体健康均有害,不宜食用 |
| C、硫、氮的氧化物会造成酸雨,酸雨指pH小于7的雨水 |
| D、明矾是常用的水处理剂,可用于城市自来水的杀菌消毒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com