
下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g) = 2H2O(g) ΔH= - 483.6 kJ·mol-1,则氢气的燃烧热为241.8kJ·mol-1
B.已知C(石墨,s)= C(金刚石,s) ΔH=+1.9kJ·mol-1,则金刚石比石墨稳定
C.含0.5mol NaOH的稀溶液与稀醋酸完全中和,放出26.7kJ的热量,则表示该反应中和热的热化学方程式为:OH-(aq) +H+(aq)= H2O(l) ΔH
+H+(aq)= H2O(l) ΔH =-53.4kJ·mol-1
=-53.4kJ·mol-1
D.已知2H2S(g)+ O2(g)= 2S(g)+2H2O(l) ΔH1 ;
2H2S(g )+ 3O2(g)=2SO2(g)+2H2O(l)ΔH2,则ΔH1>ΔH2
)+ 3O2(g)=2SO2(g)+2H2O(l)ΔH2,则ΔH1>ΔH2
科目:高中化学 来源: 题型:
25℃时,将一定浓度的盐酸和一定浓度的氨水按2∶1 的体积比混合,若混合溶液中c(NH )=c(Cl-),则溶液的pH
)=c(Cl-),则溶液的pH
A.大于7 B.小于7 C.等于7 D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)有人研究证明:使用氯气作自来水消毒剂,氯气会与水中有机物反应,生成如CHCl3等物质,这些物质可能是潜在的致癌致畸物质。目前人们已研发多种饮用水的新型消毒剂。下列物质不能作自来水消毒剂的是 (填序号)。
A.明矾 B.二氧化氯 C.臭氧 D.高铁酸钠( Na2FeO4)
(2)高铁(VI)酸盐是新一代水处理剂。其制备方法有:次氯酸盐氧化法(湿法)和高温过氧化物氧化法(干法)等。湿法是在碱性溶液中用次氯酸盐氧化铁(III)盐,写出该法的离子方程式: 。
(3)用高铁(VI)酸盐设计的高铁(VI)电池是一种新型可充电电池,电解质溶液为KOH溶液,放电时的总反应:3Zn+2K2FeO4+8H2O→3Zn(OH)2+2Fe(OH)3+4KOH
①写出正极发生的电极反应式: 。
②用高铁(VI)电池作电源,以Fe作阳极,以Cu作阴极,对足量KOH溶液进行电解,当有0.1molK2FeO4反应时,在电解池中生成H2 L(标准状况),同时生成Fe(OH)3= mol。
③下表列出了某厂排放的含锌废水中的含量及国家环保标准值的有关数据:
| 含锌废水水质 | 经处理后的水国家环保标准值 | |
| Zn2+浓度/(mg·L-1) | ≤800 | ≤3.9 |
| pH | 1~5 | 6~9 |
经处理后的废水pH=8,此时废水中Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17), (填“符合”或“不符合”)国家环保标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
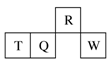
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是
A.最简单气态氢化物的热稳定性:R>Q
B.原子半径:T>Q>R
C.最高价氧化物对应水化物的酸性:Q<W
D.含T的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.在原电池中,负极材料的活性一定比正极材料强
B.将氯化铁溶液蒸干可得无水氯化铁固体
C.反应2NO2(g)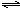 N2O4(g)在常温下就能自发进行,则该反应的ΔH>0
N2O4(g)在常温下就能自发进行,则该反应的ΔH>0
D.氯化铵溶液中加入镁,会产生两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是 ( )
A.将等体积pH=4的盐酸和醋酸稀释到pH=5的溶液,盐酸所加的水量多
B.盐酸和醋酸都可用相应的钠盐和浓硫酸反应制取
C.0.1mol·L-1醋酸钠溶液的pH>7
D.相同pH的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
(1) 常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入 0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
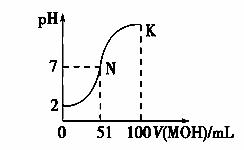
①由图中信息可知HA为________(填“强”或“弱”),理由是___________。
②常温下一定浓度的MA稀溶液的pH=a,则a________7(填“>”、“<”或“=”)。
③请写出K点所对应的溶液中离子浓度的大小关系: 。
(2)已知25 ℃时0.1 mol·L-1醋酸溶液的pH约为3,向其中加入醋酸钠晶体,等晶体溶解后发现溶液的pH增大。对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,增大了c(OH-),因而溶液的pH增大;乙同学认为醋酸钠溶于水电离出大量醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的pH增大。
①为了验证上述哪种解释正确,做如下实验:向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的________(填写编号),然后测定溶液的pH。
A.固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
②若乙的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C三种化合物,各取40 g相混合,完全反应后,得到18 g B、49 g C,还有D生成。已知D的相对分子质量为106。现将22 g A和11 g B反应,能生成D的物质的量是( )
A.1 mol B.0.5 mol
C.0.275 mol D.0.25 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com