
【题目】合成氨是人工固氮最重要的途径,反应的热化学方程式如下:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1。
2NH3(g) ΔH=-92.4kJ·mol-1。
(1)工业上有利于提高合成氨产率的条件有___。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(2)关于合成氨的说法,正确的是__。
A.合成氨反应的ΔH和ΔS都小于零
B.控制在773K下反应,目的是加快反应速率和提高平衡转化率
C.将NH3液化后移去,利于反应速率提高和平衡正向移动
D.原料气须经过净化处理,以防止催化剂中毒和事故发生
(3)若N2、H2的初始投入量分别为0.1mol、0.3mol,在恒容容器中反应,平衡后混合物中氨的体积分数(ψ)与温度、压强的关系如图所示。
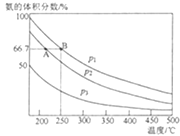
①比较p2、p3的大小:p2__p3(填“>”“<”或“=”),其原因是__。
②比较平衡时A、B点对应的化学反应速率:VA(N2)__VB(N2)(填“>”“<”或“=”)。
③若起始压强为1×108Pa,则平衡时B点的压强为___Pa。
(4)科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨,阴极区发生的变化可按两步进行。已知第一步的反应为:Fe2O3+6e-+3H2O=2Fe+6OH-,则第二步的反应方程式为___。
【答案】BDE AD > 温度相同时,增大压强,化学平衡向正反应方向移动,平衡混合物中氨的体积分数增大 < 6×107 2Fe+3H2O+N2=2NH3+Fe2O3
【解析】
(1)工业上有利于提高合成氨产率的条件从有利于提高单位时间里氨气的产量这个角度来考虑;
(2)A. 从合成氨反应的热化学反应方程式可以判断ΔH和ΔS都小于零;
B. 从温度对反应速率和平衡的影响来判断;
C. 从减少生存物氨气的浓度对反应速率和平衡的影响来判断;
D. 从原料气对于催化剂催化效能的影响以及会否引发事故的角度来判断;
(3)①氨气的体积分数不同的原因在压强,通过相同温度不同压强下氨气的体积分数大小,判断平衡移动的方向,比较p2、p3的大小;
②平衡时A、B点对应的化学反应速率不同的原因主要是压强、温度,从压强、温度对反应速率的影响来判断;
③若N2、H2的初始投入量分别为0.1mol、0.3mol,在恒容容器中反应,若起始压强为1×108Pa,则计算平衡时B点的压强,可通过压强之比等于混合气体总的物质的量之比来计算,用三段式计算平衡时混合气体总的物质的量;
(4)阴极区发生还原反应,找出阴极总反应,已知第一步的反应为:Fe2O3+6e-+3H2O=2Fe+6OH-,纳米Fe2O3作催化剂,首先转化为铁,则第二步的反应中要重新生成Fe,据此写出第二步方程式;
(1)合成氨是气体分子数减小的放热反应,高压有利于平衡右移,有利于提高产率,高温虽然不利于氨的合成,但大大提高了合成氨的速率有利于提高产率,催化剂能极大地提高反应的速率,也有利于提高产率;
答案为:BDE;
(2)
A.合成氨是气体分子数减小的放热反应,故合成氨反应的ΔH和ΔS都小于零,说法正确;
B.在773K下反应,目的是保证催化剂的活性加快反应速率,不利于提高平衡转化率,说法错误;
C.将NH3液化后移去,利于平衡正向移动,减少反应速率,说法错误;
D.原料气假如不净化,有杂质气体,会引起催化剂中毒,假如含有毒气体有可能发生安全事故,说法正确;
答案为:AD;
(3)①温度相同时,增大压强化学平衡向正反应方向移动,故平衡混合物中氨的体积分数越大压强越大,由图知p2下氨的体积分数大于p3下氨的体积分数;则p2>p3
答案为:>;
p2>p3的原因:温度相同时增大压强化学平衡向正反应方向移动来;
答案为:温度相同时,增大压强,化学平衡向正反应方向移动,平衡混合物中氨的体积分数增大;
②温度越大,压强越大,反应速率越大,p1>p2,由图可知,B对应的温度、压强大,则反应速率大;
答案为:<;
③若N2、H2的初始投入量分别为0.1mol、0.3mol,在恒容容器中反应,若起始压强为1×108Pa,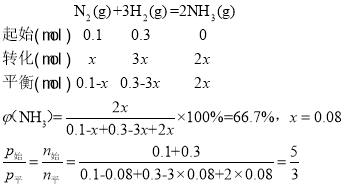
因为p始= 1×108Pa,所以p平= 6×107Pa;
答案为:6×107;
(4)阴极区发生还原反应,阴极总反应可表示为:N2+6e-+6H2O=2NH3+6OH-,已知第一步的反应为:Fe2O3+6e-+3H2O=2Fe+6OH-,纳米Fe2O3作催化剂,首先转化为铁,则第二步的反应中要重新生成Fe,方程式为2Fe+3H2O+N2=2NH3+Fe2O3;
答案为:2Fe+3H2O+N2=2NH3+Fe2O3。


科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
 NaCl晶胞
NaCl晶胞
A.124g P4含有的P-P键数为6NA
B.12g石墨中含有的C-C键数为2NA
C.58.5g NaCl中晶胞数为NA
D.12g金刚石中含有的C-C键数为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将0.100mol·L—1的NaOH溶液滴加到20mL 0.100mol·L—1的草酸(分子式为H2C2O4,二元弱酸)溶液中,滴加过程中,溶液中H2C2O4、HC2O4-、C2O42-的物质的量分数随pH的变化曲线如图所示,下列叙述正确的是
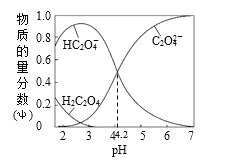
A.电离常数Ka1(H2C2O4)=10—4.2
B.当滴入10mLNaOH溶液时:c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+2c(C2O42-)
C.pH=7.0的溶液中:c(Na+)<2c(C2O42-)
D.当滴入20mLNaOH溶液时:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是( )
A.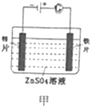 甲图装置可以实现铁片上镀锌
甲图装置可以实现铁片上镀锌
B.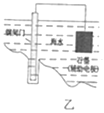 乙图表示钢闸门用牺牲阳极的阴极保护法加以防护
乙图表示钢闸门用牺牲阳极的阴极保护法加以防护
C.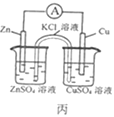 丙图中,盐桥中的K+向盛有ZnSO4溶液的烧杯中移动
丙图中,盐桥中的K+向盛有ZnSO4溶液的烧杯中移动
D.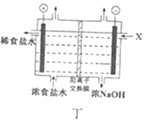 丁图中,X处补充稀NaOH溶液以增强溶液导电性
丁图中,X处补充稀NaOH溶液以增强溶液导电性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:
MnO2+![]() Zn+(1+
Zn+(1+![]() )H2O+
)H2O+![]() ZnSO4
ZnSO4![]() MnOOH+
MnOOH+![]() ZnSO4[Zn(OH)2]3·xH2O
ZnSO4[Zn(OH)2]3·xH2O
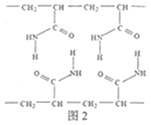
其电池结构如图1所示,图2是有机高聚物的结构片段。

下列说法中,正确的是( )
A.碳纳米管具有导电性,可用作电极材料
B.放电时,电池的正极反应为MnO2-e-+H+=MnOOH
C.充电时,Zn2+移向MnO2
D.合成有机高聚物的单体是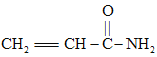
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CO2分子晶体可转化为具有类似SiO2结构的原子晶体.从理论上分析,下列说法正确的是( )
A.该转化过程是物理变化
B.1molCO2原子晶体中含2mol C﹣O键
C.CO2原子晶体的熔点高于SiO2
D.CO2的原子晶体和分子晶体互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卡巴拉丁F是老年人认知障碍的重要治疗药物。其合成路线如图所示:
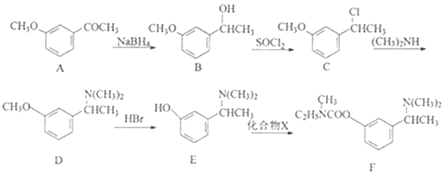
(1)B中含氧官能团的名称为___。
(2)B→C的反应类型为___。
(3)化合物X(C4H3ONCl)的结构简式为__。
(4)写出同时满足下列条件的A的一种同分异构体的结构简式:__。
①能水解,水解产物之一能与FeCl3溶液发生显色反应。
②分子中含有4种不同化学环境的氢。
(5)已知:RX![]() RCN
RCN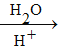 RCOOH
RCOOH
RX+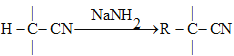
以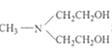 和苯为主要原料制备
和苯为主要原料制备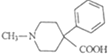 ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种短周期元素![]() 、
、![]() ,
,![]() 元素原子的最外层电子数为
元素原子的最外层电子数为![]() ,次外层电子数为
,次外层电子数为![]() ;
;![]() 元素原子的
元素原子的![]() 层(有电子)电子数为
层(有电子)电子数为![]() ,
,![]() 层电子数为
层电子数为![]() 。
。
(1)推断元素名称和符号:![]() _______、______,
_______、______,![]() ______、_______。
______、_______。
(2)![]() 、
、![]() 两元素形成的化合物可能具有的性质是_______(填序号)。
两元素形成的化合物可能具有的性质是_______(填序号)。
A.能与水反应 B.能与硫酸反应 C.能与氢氧化钠溶液反应
(3)![]() 元素的原子含有_______个能层,Y元素的原子含有_______个能层。
元素的原子含有_______个能层,Y元素的原子含有_______个能层。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以烯烃为原料,合成某些高聚物的路线如图:

已知:Ⅰ.![]() (或写成
(或写成![]() R代表取代基或氢)
R代表取代基或氢)
Ⅱ.甲为烃
Ⅲ.F能与NaHCO3反应产生CO2请完成以下问题:
(1)CH3CH=CHCH3的名称是______,Br2的CCl4溶液呈______色.
(2)X→Y的反应类型为:______;D→E的反应类型为:______.
(3)H的结构简式是______.
(4)写出下列化学方程式:
A→B______;
Z→W______.
(5)化工生产表明高聚物H的产率不及设计预期,产率不高的原因可能是______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com