
ЁОЬтФПЁПЯТЭМЪЧвЛжжаТаЭяЎЕчГизАжУЃЌЕчГиГфЁЂЗХЕчЗДгІЮЊxLi+LiV3O8![]() Li1+xV3O8ЁЃ ЗХЕчЪБЃЌашЯШв§ЗЂЬњКЭТШЫсМиЗДгІЪЙЙВОЇЬхШлЛЏЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
Li1+xV3O8ЁЃ ЗХЕчЪБЃЌашЯШв§ЗЂЬњКЭТШЫсМиЗДгІЪЙЙВОЇЬхШлЛЏЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ

A. ЙВОЇбЮДЂШШаЇЙћКУЃЌРћгкЕчНтжЪШлЛЏ
B. ећИіЙ§ГЬЕФФмСПзЊЛЏжЛЩцМАЛЏбЇФмзЊЛЏЮЊЕчФм
C. ЗХЕчЪБLiV3O8ЕчМЋЗДгІЮЊxLi++xe-+LiV3O8=Li1+xV3O8
D. ГфЕчЪБCl-вЦЯђLiV3O8ЕчМЋ
ЁОД№АИЁПB
ЁОНтЮіЁПA. ЙВОЇбЮЪЧгХСМЕФДЋШШДЂФмНщжЪЃЌвђЖјЦфДЂШШаЇЙћКУЃЌгЩгкЦфОпгаНЯИпЕФБШШШШнЃЌвђЖјгаРћгкЕчНтжЪШлЛЏЃЌAе§ШЗЃЛB. ећИіЙ§ГЬЕФФмСПзЊЛЏГ§ЩцМАЛЏбЇФмзЊЛЏЮЊЕчФмжЎЭтЃЌЛЙЩцМАШШФмгыЛЏбЇФмжЎМфЕФзЊЛЏЃЌBВЛе§ШЗЃЛC. ЗХЕчЪБLiV3O8ЕчМЋЪЧе§МЋЃЌЦфЗЂЩњЛЙдЗДгІЃЌЕчМЋЗДгІЮЊxLi++xe-+LiV3O8=Li1+xV3O8ЃЌCе§ШЗЃЛD. ГфЕчЪБЃЌLiV3O8ЕчМЋЪЧбєМЋЃЌЙЪCl-вЦЯђLiV3O8ЕчМЋЃЌDе§ШЗЁЃБОЬтбЁBЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪТЪЕВЛФмгУЛЏбЇЦНКтвЦЖЏдРэНтЪЭЕФЪЧЃЈЁЁЁЁЃЉ
A.ЙтееаТжЦЕФТШЫЎЪБЃЌШмвКЕФpHж№НЅМѕаЁ
B.ЙЄвЕЩњВњжаЃЌ500ЁцзѓгвБШГЃЮТЯТИќгаРћгкКЯГЩАБ
C.ПЩгУХЈАБЫЎКЭЧтбѕЛЏФЦЙЬЬхПьЫйжЦШЁАБЦј
D.діДѓбЙЧПЃЌгаРћгкSO2КЭO2ЗДгІЩњГЩSO3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪЕбщЪвгУЯТСазАжУжЦБИЮоЫЎAlCl3(183ЁцЩ§ЛЊ)ЃЌЮоЫЎAlC13гіГБЪЊПеЦјМДВњЩњДѓСПАзЮэЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ

A. bЁЂcЁЂfжавРДЮЪЂзАБЅКЭЪГбЮЫЎЁЂХЈСђЫсЁЂХЈСђЫс
B. gжаЗЂЩњЕФЗДгІЮЊCl2+2NaOH=NaCl+NaClO+H2O
C. eзАжУЕФЪеМЏЦїБиаыБЃГжИЩдя
D. ЪЕбщЪБЃЌaКЭdДІОЦОЋЕЦгІЭЌЪБЕуШМ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНќФъРДЃЌДХадВФСЯЕФбаОПБИЪмЙњМЪДХбЇНчЕФЙизЂЁЃFe3O4ОпгааэЖргХвьЕФадФмЃЌдкДХадВФСЯЕШСьгђгІгУЙуЗКЁЃЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЫЎШШЗЈжЦБИFe3O=ФЩУзПХСЃЕФзмЗДгІЮЊ3Fe2++2S2O32-+O2+4OHЁЅ=Fe3O4+S4O62-+2H2OЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ_________(ЬюзжФИ)
A.S2O32-ЪЧбѕЛЏМС
B.БЛбѕЛЏЕФFe2+КЭЮДБЛбѕЛЏЕФFe2+ИіЪ§жЎБШЮЊ1ЃК2
C.УПЩњГЩ1 mol Fe 3O4ЃЌдђзЊвЦЕчзгЪ§ЮЊ2mol
D.ИУЗДгІжабѕЛЏМСгыЛЙдМСЕФЮяжЪЕФСПжЎБШЮЊ1ЃК4
ЃЈ2ЃЉвбжЊЃКH2O(1)=H2(g)+1/2O2(g) ЁїH1=+285.5kJЁЄmol-1ЃЌвдЬЋбєФмЮЊШШдДЗжНтFe3O4ЃЌОгЩШШЛЏбЇЬњбѕЛЏКЯЮябЛЗЗжНтЫЎжЦH2ЕФЙ§ГЬШчЯТЃКЙ§ГЬIЕФШШЛЏбЇЗНГЬЪНЮЊ2Fe3O4(s) ![]() 6FeO(s)+O2(g) ЁїH2=+313.2kJЁЄmol-1ЃЌдђЙ§ГЬIIЕФШШЛЏбЇЗНГЬЪНЮЊ____________ЁЃ
6FeO(s)+O2(g) ЁїH2=+313.2kJЁЄmol-1ЃЌдђЙ§ГЬIIЕФШШЛЏбЇЗНГЬЪНЮЊ____________ЁЃ

ЃЈ3ЃЉЛЏбЇЙВГСЕэЗЈЪЧжЦБИFe3O4ПХСЃзюГЃгУЕФЗНЗЈжЎвЛЃЌЗНЗЈЪЧНЋFeSO4КЭFeCl3ШмвКвд1ЃК2ЭЖСЯБШЛьКЯЃЌдйМгШыNaOHШмвКЃЌМДПЩВњЩњFe3O4ПХСЃЃЌдђИУЗДгІЕФРызгЗНГЬЪНЮЊ______________________ЃЌгЩЯТБэЪ§ОнПЩжЊЃЌFe2+КЭFe3+ЕФзюМбЭЖСЯБШЮЊ1ЃК1.85ЃЌдвђПЩФмЪЧ_____________________ЁЃ
Бэ ВЛЭЌЭЖСЯБШЕУЕНFe3O4ЕФНсЙћ

ЃЈ4ЃЉДХЬњПѓ(Fe3O4)ЪЧЙЄвЕЩЯвБСЖЬњЕФдСЯжЎвЛЃЌЗЂЩњЕФжївЊЗДгІЮЊFe3O4(s)+4CO![]() 3Fe(s)+4CO2ЃЌИУЗДгІЕФЁїH<0ЃЌTЁцЪБЃЌдк1LКуШнУмБеШнЦїжаЃЌМгШыFe3O4ЁЂCOИї0.5molЃЌ10minКѓЗДгІДяЕНЦНКтЪБЃЌШнЦїжаCO2ЕФХЈЖШЪЧ0.4molЁЄL-1ЁЃ
3Fe(s)+4CO2ЃЌИУЗДгІЕФЁїH<0ЃЌTЁцЪБЃЌдк1LКуШнУмБеШнЦїжаЃЌМгШыFe3O4ЁЂCOИї0.5molЃЌ10minКѓЗДгІДяЕНЦНКтЪБЃЌШнЦїжаCO2ЕФХЈЖШЪЧ0.4molЁЄL-1ЁЃ
ЂйCOЕФЦНКтзЊЛЏТЪЪЧ______________ЃЌTЁцЪБЃЌИУЗДгІЕФЦНКтГЃЪ§K=__________ЁЃ
ЂкгћЬсИпИУЗДгІжаCOЕФЦНКтзЊЛЏТЪЃЌПЩВЩШЁЕФДыЪЉЪЧ_____________(ШЮаДвЛИіМДПЩ)ЁЃ
ЂлЦфЫћЬѕМўВЛБфЪБЃЌИУЗДгІдкВЛЭЌЮТЖШЯТЃЌCO2КЌСПЫцЪБМфЕФБфЛЏ![]() (CO2)~tЧњЯпШчЭМЫљЪОЃЌЮТЖШT1ЁЂT2ЁЂT3гЩДѓЕНаЁЕФЙиЯЕЪЧ___________ЃЌХаЖЯвРОнЪЧ____________ЁЃ
(CO2)~tЧњЯпШчЭМЫљЪОЃЌЮТЖШT1ЁЂT2ЁЂT3гЩДѓЕНаЁЕФЙиЯЕЪЧ___________ЃЌХаЖЯвРОнЪЧ____________ЁЃ

ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПНЈЩшУРРіжаЙњЃЌГЋЕМЙВЭЌааЖЏЃЌХЌСІИФЩЦЛЗОГЃЌБЃЛЄМвдАЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. АбЯѕЫсЙЄГЇЕФбЬДбНЈдьЕУИќИпвЛаЉЃЌвдБмУтЕЊбѕЛЏЮяЕФХХЗХ
B. ЭЦЙуШМУКЗЂЕчЃЌЭЃНЈКЫЕчеОЃЌвдЗРКЫаЙТЉЪТЙЪЗЂЩњ
C. НЋЗЯЕчГиЩюТёЃЌПЩвдБмУтЦфжаЕФжиН№ЪєЮлШО
D. ШМУКжаЬэМгCaOЃЌПЩвдМѕЩйЫсгъЕФВњЩњ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПяЎЪЧУмЖШзюаЁЕФЛюЦУН№ЪєЃЌЦфЕЅжЪМАЦфЛЏКЯЮяШчЃКLiAlH4ЁЂLi2CO3ЁЂ LiPF6ЕШгаЙуЗКЕФгУЭОЁЃЙЄвЕЩЯвдяЎЛдЪЏЃЈжївЊГЩЗжЮЊLiAlSi2O6ЃЌЛЙКЌгаСђЫсИЦЁЂСђЫсУОКЭЬњЕФбѕЛЏЮяЃЉЮЊдСЯЃЌжЦБИLi2CO3ЕФЕФЙЄвеСїГЬШчЯТЃК

вбжЊЂйLiAlSi2O6КЭH2SO4ЛсЩњГЩSiO2
Ђк
Fe3+ | A13+ | Fe2+ | Mg2+ | |
ЧтбѕЛЏЮяЭъШЋГСЕэpH | 3.2 | 4.7 | 9.0 | 11.1 |
ЂлФГаЉЮяжЪЕФШмНтЖШ(S) ШчЯТБэ
t/Ёц | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉLiAlSi2O6ИФаДГЩбѕЛЏЮяЕФаЮЪНЪЧ___________________ЁЃ
МКжЊБэжа40ЁцLi2CO3ШмНтЖШ(БЅКЭШмвКЕФУмЖШЮЊag/cm3)ЃЌдђLi2CO3ЕФШмЖШЛ§(Ksp) ЮЊ________ЃЌ(гУКЌгаaЕФДњЪ§ЪНБэЪО)
ЃЈ2ЃЉВНжшЂђдкТЫвКaжаМгШыЕФГ§дгМСвРДЮЮЊЪЪСПЕФH2O2ШмвКЃЌЪЏЛвШщКЭNa2CO3ШмвКЃЌЗЂЩњбѕЛЏЛЙдЗДгІЕФРызг ЗНГЬЪНЮЊ____________________ЁЃ
ЃЈ3ЃЉМКжЊТЫдќ2 ЕФжївЊГЩЗжгаMg(OH)2 ЁЃЯђТЫвКaжаМгШыЪЏЛвШщЕФзїгУЪЧ(дЫгУЛЏбЇЦНКтдРэМђЪі)___________________ЁЃгУШШЫЎЯДЕгLi2CO3ЙЬЬхФПЕФЪЧ___________________ЁЃ
Ђђ.яЎЕЅжЪжЦБИМАЦфЛЏКЯЮяЕФаджЪ
1ЃЉгУЬМЫсяЎКЭбЮЫсЗДгІЕУЕНТШЛЏяЎШмвКЃЌаДГіШчКЮДгТШЛЏяЎШмвКЕУЕНЮоЫЎТШЛЏяЎЙЬЬхЕФЪЕбщЗНЗЈ__________________ЁЃ
ЃЈ2ЃЉ вбжЊ2Li+H2![]() 2LiHЃЌLiHЙЬЬхУмЖШЮЊ0 8g/cm3ЃЌгУяЎЮќЪе22.4L (БъзМзДПі) H2ЃЌ ЩњГЩЕФLiHЬхЛ§гы БЛЮќЪе ЕФ H2 ЬхЛ§ БШ ЮЊ________________ЁЃ
2LiHЃЌLiHЙЬЬхУмЖШЮЊ0 8g/cm3ЃЌгУяЎЮќЪе22.4L (БъзМзДПі) H2ЃЌ ЩњГЩЕФLiHЬхЛ§гы БЛЮќЪе ЕФ H2 ЬхЛ§ БШ ЮЊ________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТЭМЪЧдЊЫижмЦкБэЕФвЛВПЗжЃЌБэжаЕФЂй~ЂсжадЊЫиЃЌгУдЊЫиЗћКХЛђЛЏбЇЪНЬюПеЛиД№ЃК
| ЂёA | ЂђA | ЂѓA | ЂєA | ЂѕA | ЂіA | ЂїA | 0 |
Жў | Ђй | Ђк | ||||||
Ш§ | Ђл | Ђм | Ђн | Ђо | Ђп | Ђр | ||
ЫФ | Ђс |
ЃЈ1ЃЉдкетаЉдЊЫижаЃЌЛЏбЇаджЪзюВЛЛюЦУЕФдзгЕФдзгНсЙЙЪОвтЭМЮЊЁЃ
ЃЈ2ЃЉЕиПЧжаКЌСПзюЖрЕФН№ЪєдЊЫиЪЧЁЃ
ЃЈ3ЃЉЂкгыЂмаЮГЩЕФЛЏКЯЮяЕФЕчзгЪНЁЃ
ЃЈ4ЃЉетаЉдЊЫижаЕФзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяжаЃЌЫсадзюЧПЕФЪЧ ЃЌ МюадзюЧПЕФЪЧ ЃЌ ГЪСНадЕФЧтбѕЛЏЮяЪЧЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиЮяжЪаджЪгыгУЭООпгаЖдгІЙиЯЕЕФЪЧЃЈ ЃЉ
A.ФЦЕФУмЖШаЁЃЌПЩгУгкжЦИпбЙФЦЕЦB.Al2O3ШлЕуИпЃЌПЩгУгкжЦФЭИпЮТВФСЯ
C.MnO2ВЛШмгкЫЎЃЌПЩзїH2O2ЗжНтЕФДпЛЏМСD.ЛюадЬПОпгаЛЙдадЃЌПЩгУзїОЛЫЎМС
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊЃКГЃЮТЯТЃЌЂйKa1(H2CO3)=4.3ЁС10-7ЃЌKa2(H2CO3)=5.6ЁС10-12 ЂкH2RМАЦфФЦбЮЕФШмвКжаЃЌH2RЁЂHR-ЁЂR2-ЗжБ№дкШ§епжаЫљеМЕФЮяжЪЕФСПЗжЪ§(ЈЛ)ЫцШмвКpHЕФБфЛЏЙиЯЕШчЭМЫљЪОЁЃЯТСаа№ЪіДэЮѓЕФЪЧ
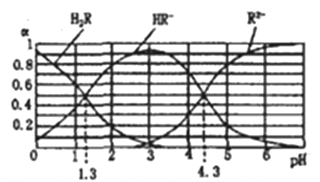
A. дкpH=4.3ЕФШмвКжаЃК3c(R2-)=c(Na+)+c(H+)-c(OH-)
B. ЯђNa2CO3ШмвКжаМгШыЩйСПH2RШмвКЃЌЗЂЩњЗДгІЃК2CO32-+H2R=2HCO3-+R2-
C. дкpH=1.3ЕФШмвКжаДцдк![]() =10-3
=10-3
D. ЕШЬхЛ§ЕШХЈЖШЕФNaOHШмвКгыH2RШмвКЛьКЯКѓЃЌШмвКжаЫЎЕФЕчРыГЬЖШБШДПЫЎДѓ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com