
| �¶�/�� | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |

| c |
| 2-c |
| 1mol/L |
| 2mol/L |
| c(CO) |
| c(CO2) |
| c(H2) |
| c(H2O) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| K1 |
| K2 |
| 2.4 |
| 1.6 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��23g������������ȫȼ��ʧ������Ϊ0.5NA |
| B����״���£�22.4L�������ķ����� |
| C�������£�8g���麬�й��ۼ���Ϊ2NA |
| D��1L 1mol?L-1������Һ������H+ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ѧʹ��ũҩ�����ʣ�����ˮ����Ⱦ |
| B����ҵ��ˮ�ͳ���������ˮ�辻����������ִ���ŷ� |
| C��Ϊ�˽�Լ�����ɱ����ɽ���ֽ��������������ˮԴ������ |
| D����������ˮ��Դ������ˮ��Դ��Լ�ͺͻ����Ѻ��;��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
70 30 |
208 82 |
277 112 |
1 0 |
| A�������ϳɹ��������ڻ�ѧ�仯 | ||
| B��CnԪ�ص����ԭ������Ϊ277 | ||
C��
| ||
| D��CnԪ��λ��Ԫ�����ڱ��ĵ������ڣ��Ǹ���Ԫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
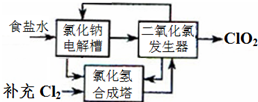 ������������Ƭ����Ч�ɷ֣�ClO2����һ�ָ�Ч����ȫ��ɱ������������
������������Ƭ����Ч�ɷ֣�ClO2����һ�ָ�Ч����ȫ��ɱ������������| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��������ĩ״�� | ���Ũ�ȼ���� | ��Ӧ�¶� | |
| A | Mg 0.1 | 3mol?L-1����10mL | 80�� |
| B | Mg 0.1 | 1.5mol?L-1����10mL | 60�� |
| C | Fe 0.1 | 1mol?L-1���� 10mL | 60�� |
| D | Mg 0.1 | 1mol?L-1����10mL | 60�� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com