


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
| A、它和苯的最简式相同 |
| B、它属于芳香烃 |
| C、它只有两种化学键 |
| D、它与苯乙烯(C6H5-CH═CH2)具有相同的分子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属氧化物一定是碱性氧化物 |
| B、非金属氧化物一定是酸性氧化物 |
| C、只有在标准状况下,气体的摩尔体积才能为22.4L/mol |
| D、非电解质在水溶液中和熔融状态下均以分子形式存在,因而不能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
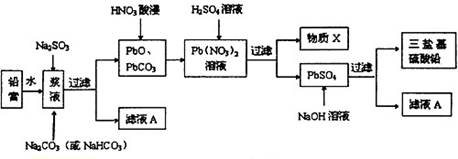
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验食盐中含有钠离子,可以用焰色反应实验,如果焰色呈黄色则可以说明含有钠离子 |
| B、检验食盐中含有氯离子,则可以加用硝酸酸化的硝酸银溶液 |
| C、向溴水中加入食盐溶液,可以使溴水褪色 |
| D、食盐中加碘的作用是预防“大脖子病”的发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
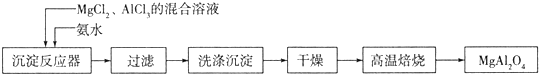
查看答案和解析>>
科目:高中化学 来源: 题型:
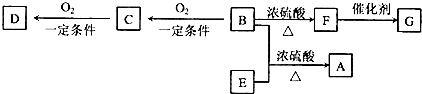
查看答案和解析>>
科目:高中化学 来源: 题型:
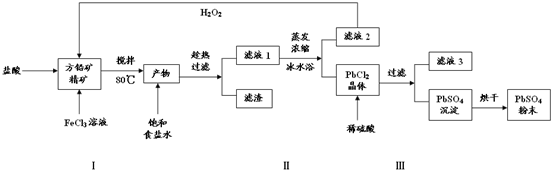
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H+(aq)+SO42- (aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ?mol-1 | ||
| B、2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l)△H=-57.3 kJ?mol-1 | ||
C、C8H18(1)+
| ||
D、C8H18(g)+
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com