
常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下,下列判断不正确的是
| 实验编号 | c(HA)/ mo1·L-l | c(NaOH)/ mol·L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | pH =9 |
| 乙 | c1 | 0.2 | pH =7 |
 H++A-
H++A-AC
解析试题分析:由于n=c?V,则甲实验中n(HA)=n(NaOH),混合溶液中溶质只有NaA,溶液pH=9,说明NaA溶液呈碱性,则NaA是强碱弱酸盐,即HA是弱酸,故B正确;由于HA与NaOH恰好完全中和所得溶液呈弱碱性,欲使溶液pH=7或呈中性,HA一定要过量且保证过量到一定程度,则n(HA)>n(NaOH),即c(HA)>c(NaOH),所以c(HA)>0.2mol/L,故A不正确;乙实验中HA过量,即n(HA)>n(NaOH),根据物料守恒原理可知,溶液中c(Na+)<c(HA)+c(A一),故C不正确;甲反应后溶液中溶质NaA的电离程度大于H2O,钠离子不能水解,部分A一与水电离出的H+结合成HA,则c(Na+)>c(A一)>c(OH一)>c(H+),故D正确。
考点:考查酸碱中和反应,涉及溶液的pH与酸碱性、强弱电解质、溶液中物料守恒原理、离子浓度大小关系等。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:单选题
氨水中有下列平衡NH3·H2O  NH4++OH- ,当其他条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是( )
NH4++OH- ,当其他条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是( )
| A.加NaOH 固体 | B.加浓HCl | C.加NH4Cl固体 | D.加同浓度的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有0.4mol·L-1HA溶液和0.2mol·L-1NaOH溶液等体积混合组成溶液。下列有关推论不正确的是
A.无论该溶液呈酸性还是碱性,都有c(Na+)+c(H+)=c(A-)+c(OH-)
B.无论该溶液呈酸性还是碱性,都有c(Na+)=c(A-)+c(HA)
C.若该溶液中HA电离能力大于A-水解能力,则有c(A'>c(Na+)>c(HA)>c(H)>c(OH-)
D.若该溶液中A-水解能力大于HA电离能力,则有c(A-)>c(Na+)>c(HA)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有关下列溶液的叙述正确的是
| A.醋酸与醋酸钠的混合溶液中:c(CH3COO-)+ c(OH-) = c(Na+) + c(H+) |
| B.1 mol·L-1Na2CO3溶液中:c(OH-) = c((H+) + c(HCO3-) + c(H2CO3) |
| C.0.1 mol·L-1的硫酸铵溶液中:c(SO42-) >c(NH4+)>c(H+)> c(OH-) |
| D.将1molKCl、1molNaHS溶于水配成1L混合溶液中: |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温时,V1mL c1 mol/L的醋酸滴加到V2 mL c2 mol/L的烧碱溶液中,下列结论正确的是
| A.若V1=V2且混合溶液pH<7,则有c1>c2 |
| B.若c1V1= c2V2,则混合溶液中c(Na+)= c(CH3COO-) |
| C.若混合溶液的pH=7,则有c1V1>c2V2 |
| D.若混合溶液的pH=7,则混合溶液中c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下有0.1mol·L-1的NaHA溶液,其pH=9,下列说法正确的是( )
A.c(Na+)=c(HA-)+c(A2-)+c(H2A)
B.c(HA-)>c(Na+)>c(OH-)>c(H+)
C.c(Na+)>c(HA-)>c(OH-)>c(H2A)
D.c(H+)+2c(H2A)= c(OH-) +c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,将 pH和体积都相同的盐酸和醋酸溶液分别加蒸馏水稀释,pH随溶液体积变化如下图,下列有关叙述正确的是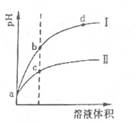
| A.曲线I为醋酸稀释时pH值变化曲线 |
| B.a点时,若都加入相同大小的锌粒,此时与盐酸反应的速率大 |
| C.a点时,若都加入足量的锌粒,最终与醋酸反应产生的氢气多 |
| D.b点溶液中水的电离程度比c点溶液中水的电离程度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有室温下两种溶液,有关叙述正确的是
| 编号 | ① | ② |
| pH | 12 | 2 |
| 溶液 | 氢氧化钠溶液 | 醋酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)常温下,有0.1mol/L的盐酸和0.1mol/L的醋酸溶液,回答下列问题:
①比较两溶液的pH,盐酸 (填“<”、“=”或“>”)醋酸,写出醋酸电离的方程式 。
②两种酸均能与氢氧化钠反应生成盐,其中醋酸与氢氧化钠反应能生成醋酸钠,实验室现有部分醋酸钠固体,取少量溶于水,溶液呈 性(填“酸” 、“中” 或 “碱”),其原因是(用离子方程式表示) 。
(2)向盛有1 mL 0.1 mol/L MgCl2溶液的试管中滴加2滴2mol/L NaOH溶液,有白色沉淀生成,再滴加2滴0.1mol/LFeCl3溶液,静置。可以观察到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com