
甲方案:Na2SO4溶液、稀盐酸、H2S、NaOH溶液
乙方案:稀盐酸、Na2SO4溶液、H2S、NaOH溶液
丙方案:NaCl溶液、Na2SO4溶液、NaOH溶液、Na2S溶液
丁方案:Na2S溶液、Na2SO4溶液、NaCl溶液、NaOH溶液
试完成下列问题:
(1)你认为可行的方案是_________方案,反应的离子方程式有:____________________。
(2)方案_______不可行的原因是:__________________________________________。
方案_______不可行的原因是:______________________________________________。
方案_______不可行的原因是:______________________________________________。
科目:高中化学 来源: 题型:
 某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如右(写出最佳答案)
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如右(写出最佳答案)查看答案和解析>>
科目:高中化学 来源: 题型:
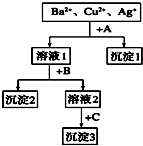 某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程如图(写出最佳答案).
某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程如图(写出最佳答案).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+ | B、HCO3- | C、Cl- | D、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)某溶液中含有Ba2+、Cu2+、Ag+三种离子。现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右所示(写出最佳答案)
(1)沉淀的化学式:沉淀1 ,沉淀2 ,沉淀3 ; (2)写出混合液+A的离子方程式: 。
溶液+B的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2010年山东省寿光市高一上学期期中考试化学试卷 题型:选择题
某溶液中含有Ba2+、Cu2+ 和Ag+,现用氢氧化钠、盐酸和硫酸钠溶液将三种离子逐一沉淀分离。其流程如下图所示:(其中“溶液2”为无色溶液)
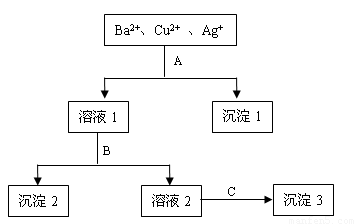
回答下列问题:
(1)沉淀1的化学式: 。
(2)写出下列反应的离子方程式:
溶液1 + B: 。
溶液2 + C: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com