【答案】
分析:空气的平均分子质量是29,现混合气体的平均相对分子质量28.9375,说明烯烃A的相对分子质量小于28.9375,A是乙烯.
当温度高于100℃,分子式为CxHy的烃在空气中完全燃烧,其体积变化规律:
CxHy+(x+
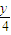
)O
2→x CO
2+
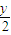
H
2O 体积变化△V
1 x+
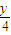
x x+
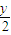
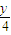
-1
y=4 总体积不变,y<4 总体积减小,y>4 总体积增大,乙烯分子中的氢原子是4,所以甲混合气体燃烧前后体积不变.
乙中的乙烯燃烧时对体积没有影响,现燃烧后体积增大,说明其中的炔烃所含的氢原子大于4,又因为常温下该炔烃是气体,所含的碳原子在2-4之间.因此可推断该炔烃的分子式为C
4H
6,
(1)根据空气的平均分子质量是29,现混合气体的平均相对分子质量28.9375,说明烯烃A的相对分子质量小于28.9375,A是乙烯;
发生反应C
nH
2n+
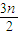
O
2→nCO
2+nH
2O,恰好反应,该烯烃与氧气按1:
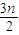
=2:3n混合,则该烃与空气按2:
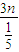
=2:15n混合,根据平均摩尔质量计算公式解答;
(2)根据反应方程式,利用差量法解答;
(3)乙中的乙烯燃烧时对体积没有影响,现燃烧后体积增大,说明其中的炔烃所含的氢原子大于4,又因为常温下该炔烃是气体,所含的碳原子在2-4之间.因此可推断该炔烃的分子式为C
4H
6,根据体积变化,利用差量法计算乙炔的体积;
(4)2LC
4H
6,消耗氧气11L,则乙烯与燃烧乙烯所需的空气的体积共为89L-2L-11L×5=32L,令乙烯为yL,根据方程式表示出消耗的氧气体积,进而表示出需要空气的体积,根据乙烯与空气的总体积为32L列方程解答.
解答:解:(1)空气的平均分子质量是29,现混合气体的平均相对分子质量28.9375,说明烯烃A的相对分子质量小于28.9375,A是乙烯;
发生反应C
nH
2n+
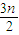
O
2→nCO
2+nH
2O,恰好反应,该烯烃与氧气按1:
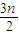
=2:3n混合,则该烃与空气按2:
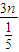
=2:15n混合,故
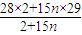
=
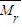
,
故答案为:C
2H
4;
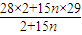
=
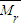
;
(2)当温度高于100℃,分子式为CxHy的烃在空气中完全燃烧,其体积变化规律:
CxHy+(x+
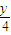
)O
2→x CO
2+
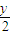
H
2O 体积变化△V
1 x+
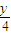
x x+
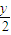
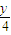
-1
y=4 总体积不变,y<4 总体积减小,y>4 总体积增大,乙烯分子中的氢原子是4,所以甲混合气体燃烧前后体积不变,故甲混合气体燃烧后的体积为89L,
故答案为:89.00L;
(3)乙中的乙烯燃烧时对体积没有影响,现燃烧后体积增大,说明其中的炔烃所含的氢原子大于4,又因为常温下该炔烃是气体,所含的碳原子在2-4之间.因此可推断该炔烃的分子式为C
4H
6,
令炔烃的体积为a,则:
2C
4H
6+11O
2→8CO
2+6H
2O 体积减少△V
2 11 8 6 1
a 90.00L-89.00L=1L
故a=2L
答:炔烃为C
4H
6,体积为2L
(4)2LC
4H
6,消耗氧气11L,A与燃烧A所需的空气的体积共为89L-2L-11L×5=32L,设A为yL,则:
C
2H
4+3O
2→2CO
2+2H
2O
y 3y
y+3y×5=32L,解得y=2L
答:乙烯的最大体积为2L.
点评:本题考查有机物分子式的确、有机物燃烧的有关计算等,难度较大,利用相对分子质量及燃烧通式确定烃的分子式是解题的关键.

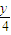 )O2→x CO2+
)O2→x CO2+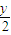 H2O 体积变化△V
H2O 体积变化△V 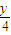 x x+
x x+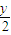
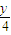 -1
-1 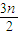 O2→nCO2+nH2O,恰好反应,该烯烃与氧气按1:
O2→nCO2+nH2O,恰好反应,该烯烃与氧气按1: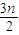 =2:3n混合,则该烃与空气按2:
=2:3n混合,则该烃与空气按2: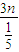 =2:15n混合,根据平均摩尔质量计算公式解答;
=2:15n混合,根据平均摩尔质量计算公式解答;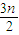 O2→nCO2+nH2O,恰好反应,该烯烃与氧气按1:
O2→nCO2+nH2O,恰好反应,该烯烃与氧气按1: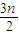 =2:3n混合,则该烃与空气按2:
=2:3n混合,则该烃与空气按2: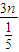 =2:15n混合,故
=2:15n混合,故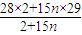 =
=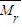 ,
,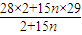 =
=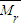 ;
; )O2→x CO2+
)O2→x CO2+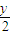 H2O 体积变化△V
H2O 体积变化△V 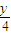 x x+
x x+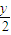
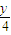 -1
-1 
