

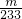 mol,
mol,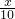
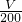 mol,故答案为:
mol,故答案为: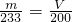


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
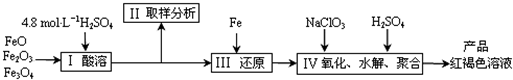
| m |
| 233 |
| V |
| 200 |
| m |
| 233 |
| V |
| 200 |
查看答案和解析>>
科目:高中化学 来源: 题型:
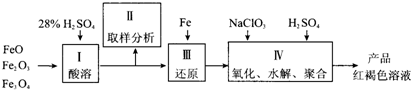
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)铁及铁的化合物在生产、生活中有着重要的用途。
(1)聚合硫酸铁(简称PFS)的化学式为 [ Fe (OH)n(S04)(3-n) / 2 ]m ,现代潜水处理工艺中常利用PFS在水体中形成絮状物,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
(2)六氰合亚铁酸钾K4[Fe(CN)6]可用做显影剂,该化合物中存在的化学键类型有_____ ____。
(3)CN一中碳原子的杂化轨道类型是 _______ :写出一种与CN一互为等电子体的分子的化学式_____ ___;
(4)三氯化铁常温下为固体,熔点304℃,沸点3160C 在3000C以上可升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为______ 晶体。
(5)普鲁士蓝是一种配合物,可用作染料,它的结构单元如下图所示,普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN一)= _____ ___。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省师大附中高二下学期期中考试化学试卷 题型:填空题
(10分)铁及铁的化合物在生产、生活中有着重 要的用途。
要的用途。
(1)聚合硫酸铁(简称PFS)的化学式为 [ Fe (OH)n(S04) (3-n) / 2 ]m ,现代潜水处理工艺中常利用PFS在水体中形成絮状物 ,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
,以吸附重金属离子。则PFS的中心原子未成对电子数为__ 个。
(2)六氰合亚铁酸钾K4[Fe(CN)6]可用做显影剂,该化合物中存在的化学键类型有_____  ____ 。
____ 。
(3)CN一中碳原子的杂化轨道类型是 _______ :写出一种与CN一互为等电子体的分子的化学式_____ ___;
(4)三氯化铁常温下为固体,熔点304℃,沸点3160C 在3000C以上可升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为______ 晶体。
(5)普鲁士蓝是一种配合物,可用作染料,它的结构单元如下图所示,普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN一)= _____ ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com