
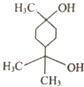
| A. | 4种 | B. | 5种 | C. | 8种 | D. | 9种 |
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2CO3和NaHCO3均可与澄清石灰水反应 | |
| B. | NaHCO3比Na2CO3热稳定性强 | |
| C. | 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同 | |
| D. | Na2CO3俗名小苏打,NaHCO3俗名纯碱,其溶液均显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
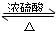 CH3COOC2H5+H2O,该反应的反应类型为取代或酯化反应.
CH3COOC2H5+H2O,该反应的反应类型为取代或酯化反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
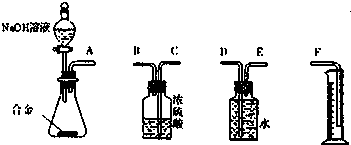
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①溶液逐渐变红色的原因是Fe2+被酸性KMnO4溶液氧化 | |
| B. | ②红色逐渐褪去的原因是酸性KMnO4溶液将SCN-氧化 | |
| C. | ②红色逐渐褪去的原因是酸性KMnO4溶液将Cl-氧化 | |
| D. | ③溶液又逐渐变色且为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
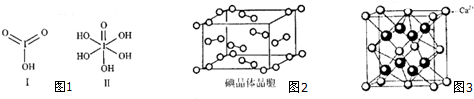
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂是为了加快反应速率,提高生产效率 | |
| B. | 升高温度可加快逆反应速率但不能改变正反应速率 | |
| C. | 一定条件下,SO2可100%转化为SO3 | |
| D. | 任何条件下,反应达到平衡,SO2的浓度一定等于SO3的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com