
| A. | 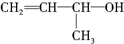 | B. | CH2═CH-CH3 | C. | 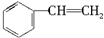 | D. | 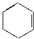 |
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液可为LiCl水溶液 | |
| B. | 该电池放电时,负极发生还原反应 | |
| C. | 放电时正极反应式为:2SOCl2+4e-=4Cl-+S+SO2 | |
| D. | 放电时电子从负极经外电路流向正极,再从正极经电解质流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、SO42-、CO32- | B. | Na+、Ca2+、SO42-、NO3- | ||
| C. | Ag+、Mg2+、Cl-、S2- | D. | Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
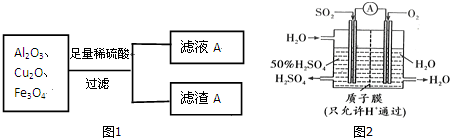
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
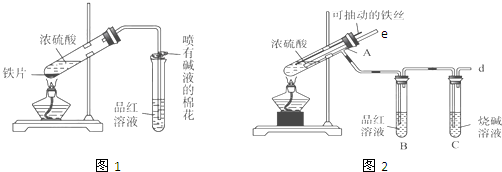
| 实验步骤 | 实验现象及结论 |
| 1、取一支洁净的试管,滴加1-2mL的试样溶液,再向试管中滴加几滴KSCN溶液 | (1)如果没有观察到溶液颜色有明显变化,则说明Ⅱ成立. (2)如果观察到溶液颜色转化为红色,则说明溶液中存在Fe3+,则Ⅰ或Ⅲ成立. |
| 2、 另取一支洁净的试管,加1-2mL试样溶液,用胶头滴管逐滴滴加酸性高锰酸钾溶液 | 如果滴加酸性高锰酸钾溶液后溶液的紫红色褪色,则说明溶液中含有亚铁离子,说明Ⅲ成立;如果滴加酸性高锰酸钾溶液后溶液紫红色不褪,则说明溶液中没有亚铁离子,说明Ⅰ成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
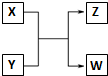 已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题:
已知X、Y、Z、W分别是由短周期元素组成的四种微粒,它们之间有如图所示的转化关系,且X是一种含有18电子的微粒,Z是一种含有10电子的微粒.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com