
分析 (1)反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O化学平衡常数K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}).{c}^{2}({H}^{+})}$;
(2)根据判断平衡状态的方法:V正=V逆,或各组分的浓度保持不变则说明已达平衡,也可根据化学平衡状态的特征:逆、定、动、变、等来回答判断;
(3)根据已知的反应物和生成物,结合元素守恒及电荷守恒书写离子方程式;根据得失电子守恒来计算;
(4)根据化学反应过程的分析判断离子种类,得出产物;根据溶度积常数计算,确定溶液中离子是否沉淀完全;
解答 解:(1)反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O化学平衡常数K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}).{c}^{2}({H}^{+})}$,故答案为:K=$\frac{c(C{r}_{2}{{O}_{7}}^{2-})}{{c}^{2}(Cr{{O}_{4}}^{2-}).{c}^{2}({H}^{+})}$;
(2)A.溶液的pH值不变,即溶液的酸性不变,氢离子浓度不变,达到了化学平衡状态,故A正确;
B.只要反应发生就是非氧化还原反应,不能作平衡状态的标志,故B错误;
C.强酸性环境,溶液的颜色为橙色,说明Cr2O72-的浓度不变,达平衡状态,故C正确;
故选:AC;
(3)第②步中Cr2O72-与Fe2+反应生成Fe3+和Cr3+,其反应的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O;根据电子得失守恒可知,还原1molCr2O72-离子得到Cr3+,得电子为2×(6-3)=6mol,需要FeSO4•7H2O的物质的量为6÷(3-2)=6mol,所以还原0.2mol Cr2O72-,需要1.2mol的FeSO4•7H2O,故答案为:1.2;
(4)根据分析③当Cr2O72-→2Cr3+变化时,溶液中产生了Cr3+的同时,又发生了Fe2+→Fe3+的过程 溶液中又产生了Fe3+,因此加入OH-又有Fe(OH)3生成;根据溶度积常数的计算,结合Cr(OH)3(s)?Cr3+(aq)+3OH(aq),当溶液的pH值调至4时,c(OH-)=1×10-10,常温下,Cr(OH)3的溶度积K sp=10-32,Ksp(Cr(OH)3)=c3(OH)•c(Cr3+),c(Cr3+)=$\frac{Ksp[Cr(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=$\frac{1{0}^{-32}}{1{0}^{-30}}$=10-2mol/L>10-5 mol/L,
故答案为:Fe(OH)3;当pH调至4时,c(OH-)=10-10 mol•L-1,c(Cr3+)=$\frac{Ksp[Cr(OH)_{3}]}{{c}^{3}(O{H}^{-})}$=10-2 mol•L-1>10-5 mol•L-1,因此Cr3+没有沉淀完全.
点评 本题综合考查了化学平衡原理、氧化还原反应、离子方程式的书写、沉淀溶解平衡和Ksp的有关计算等内容,侧重于反应原理的应用的考查,分析时要根据题给信息,结合相关原理进行解答,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 溴苯(液溴) | NaOH溶液 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
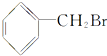 的说法中不正确的是( )
的说法中不正确的是( )| A. | 所有的碳原子在同一个平面上 | B. | 能发生水解但不能发生消去反应 | ||
| C. | 能与AgNO3溶液生成浅黄色沉淀 | D. | 能够发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Al(OH)3═Al3++3OH- | B. | KHSO4═K++H++SO${\;}_{4}^{2-}$ | ||
| C. | CH3COOH?H++CH3COO- | D. | NaH2PO4?Na++H2PO${\;}_{4}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃、陶瓷、水泥属于无机硅酸盐材料,其生产原料都是石灰石 | |
| B. | 钢铁里的铁和碳在潮湿的空气中因构成许多原电池而易发生电化学腐蚀 | |
| C. | 居室装修材料如化纤地毯、三合板、花岗岩等均会释放出污染空气的甲醛气体 | |
| D. | 聚氯乙烯塑料在日常生活中可用来进行食品包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
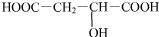 $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O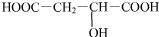 +2NaHCO3→
+2NaHCO3→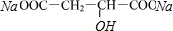 +2H2O+2CO2↑
+2H2O+2CO2↑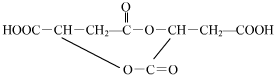 ,
,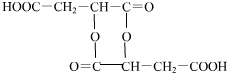 (或
(或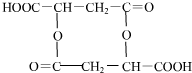 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率 | |
| B. | 制肥皂时,在皂化液里加入饱和食盐水,能够促进高级脂肪酸钠的析出 | |
| C. | 实验室制取乙烯时将温度计的水银球放在反应液面上,温度 170℃时收集气体 | |
| D. | 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com