
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| l0 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.017 | 0.034 |
| 50 | 0.032 | 0.017 | 0.034 |
分析 (1)①依据图表数据计算分析判断,K=$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$;
②依据平衡浓度之比和30min前达到的平衡浓度比较分析平衡移动方向,结合平衡移动原理判断反应热量变化;
(2)依据热化学方程式和盖斯定律计算,①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
依据盖斯定律(①+②+③×4)÷2得到;
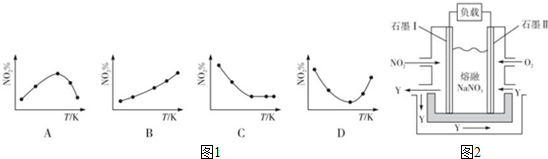
(3)①在恒容状态下,在五个相同的容器中同时通入等量的NO2,反应相同时间.达到平衡状态之前,温度越高,反应速率越大,导致NO2的百分含量越小;达到平衡后,因为该反应是放热反应,升高温度,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高;在D图中转折点为平衡状态,转折点左侧为平衡状态之前,右侧为平衡状态;
②保持温度体积不变,向上述平衡体系中再通入一定量的NO2,相当增大压强;
③燃料原电池中,负极上燃料失电子发生氧化反应;先根据化合价判断生成氧化物N2O5的电极,再根据离子的放电顺序写出电极反应式;
解答 解:(1)①30min时改变某一条件,反应重新达到平衡,平衡得到c(CO2)=0.034mol/L;c(N2)=0.017mol/L;c(NO)=0.032mol/L;K=$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$=$\frac{0.017×0.034}{(0.032)^{2}}$=0.56,化学平衡常数随温度变化,平衡常数不变说明改变的条件一定不是温度;依据数据分析,氮气浓度增大,二氧化碳和一氧化氮浓度减小,反应前后气体体积不变,所以可能是减小二氧化碳浓度;故答案为:减小N2的浓度;
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,和图表数据分析判断,平衡逆向进行,由平衡移动原理可知,升温平衡向吸热反应方向进行,所以正反应为放热反应;反应的△H<0;
故答案:<;
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
依据盖斯定律(①+②+③×4)÷2得到:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ•mol-1;
故答案为:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955 kJ•mol-1;
(3)①A、因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故A错误;
B、因为该反应是放热反应,温度越高,平衡向逆反应方向移动,NO2的百分含量随温度升高而升高,故B正确;
C、若5个容器中有未达到平衡状态的,那么温度越高,反应速率越大,会出现温度高的NO2转化得快,导致NO2的百分含量少的情况,不可能出现NO2的百分含量不变的情况,故C错误;
D、在D图中转折点为平衡状态,转折点左则为未平衡状态,右则为平衡状态,反应是放热反应,温度升高,平衡向逆反应方向移动,故D正确;
故选BD,
故答案为:BD;
②保持温度体积不变,向上述平衡体系中再通入一定量的NO2,相当增大压强,平衡正向移动,故答案为:增大;
③以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨I电极反应生成一种氧化物Y,二氧化氮在负极失电子发生氧化反应,元素化合价升高为+5价,氧化物为N2O5,反应的电极反应为:NO2+NO3--e-=N2O5;
故答案为:NO2+NO3--e-=N2O5;
点评 本题考查了热化学方程式和盖斯定律的计算应用,化学平衡的影响因素分析化学平衡移动原理的应用,平衡常数计算判断,原电池原理的应用和电极反应书写,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
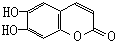 )具有抗癌作用.下列关于七叶树内酯的叙述中不正确的是( )
)具有抗癌作用.下列关于七叶树内酯的叙述中不正确的是( )| A. | 能被KMnO4酸性溶液氧化 | |
| B. | 既可以看成酚类化合物又可看成酯类化合物 | |
| C. | 能与银氨溶液发生银镜反应 | |
| D. | 1 mol该物质最多与3 mol Br2 发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电化学应用 | 相关解释或说法 | |
| A | 以稀H2SO4为电解质的Cu-Zn原电池 | Cu为正极,正极上发生还原反应 |
| B | 电解CuCl2溶液 | 电子经过负极→阴极$\stackrel{通过电解液}{→}$阳极→正极 |
| C | 弱酸性环境下钢铁腐蚀 | 负极产生H2,正极处吸收O2 |
| D | 将铜闸门与外加电源负极相连 | 牺牲阳极的阴极保护法,可防止钢闸门腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 密度(g/ml-3) | 沸点(℃) | 水溶性 | 溶解性 |
| 甲 | 0.7893 | 78.5 | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7 | 溶 | 溶于甲 |
| A. | 分液 | B. | 蒸馏 | C. | 干馏 | D. | 萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
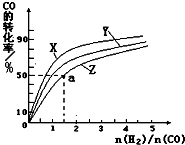 甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等压时,通入稀有气体He,反应容器中温度升高 | |
| B. | 等压时,通入Z气体,P气体的物质的量不变 | |
| C. | 等容时,通入稀有气体He,两个反应速率均不变 | |
| D. | 等容时,通入Z气体,Y的物质的量浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
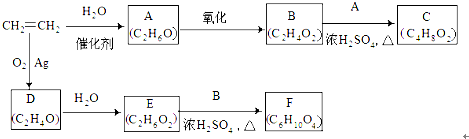
 E
E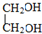 F
F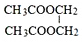 写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH
写出C酸性条件下水解的方程式CH3COOCH2CH3+H2O$?_{△}^{稀H_{2}SO_{4}}$CH3COOH+CH3CH2OH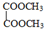 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com