
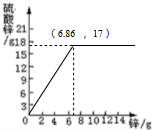
 用锌片与稀硫酸反应,实验结果记录如表
用锌片与稀硫酸反应,实验结果记录如表| 次数 | 加入Zn的质量(g) | 稀硫酸(g) | 生成ZnSO4的质量(g) |
| 1 | 2 | 60 | 5 |
| 2 | 4 | 60 | |
| 3 | 6 | 60 | 15 |
| 4 | 8 | 60 | 17 |
| 5 | 10 | 60 | |
| 6 | 12 | 60 | 17 |
| 4g |
| 2g |
| 65g×17g |
| 161g |
 ,
, ;
;| 17g×98 |
| 161 |
| 10.3g |
| 60g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
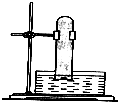 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请填写下列空白:
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com