
| A. | 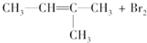 → → | |
| B. | CH2═CH-CH2-CH3+HCl$→_{△}^{催化剂}$ | |
| C. | CH3-CH═CH2+H2O$→_{加热、加压}^{催化剂}$ | |
| D. | nCH2═CH2+nCH2═CH-CH3$→_{△}^{催化剂}$ |
分析 A.烯烃与溴发生加成,只能在2、3号C上各加一个Br;
B.烯烃结构不对称,与HCl有两种加成方式;
C.烯烃结构不对称,与水有两种加成方式;
D.乙烯、丙烯发生加聚反应,甲基可能在链节的端C上,可能在链节的2号上.
解答 解:A.CH3-CH=C(CH3)2是不对称烯烃,但与溴单质反应加成产物只得到一种,产物一定为纯净物,故A正确;
B.CH2=CH-CH2CH3是不对称烯烃,与HCl加成,可得到两种加成产物,故B错误;
C.CH3-CH=CH2是不对称烯烃,与水加成得到两种不同加成产物,故C错误;
D.乙烯、丙烯发生加聚反应,甲基可能在链节的端C上,可能在链节的2号上,则产物为混合物,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握烯烃的加成反应及结构特点为解答的关键,侧重分析与应用能力的考查,注意结构对称性与加成产物的关系,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ni(OH)2 | B. | Cd(OH)2 | C. | Cd | D. | NiOOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.255g | 0.385g | 0.459g |
| 气体体积 | 280mL | 336mL | 336mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. +NaOH→
+NaOH→ +H2O.
+H2O. .
. $\stackrel{酸性KMnO_{4}溶液}{→}$CO2.
$\stackrel{酸性KMnO_{4}溶液}{→}$CO2. $\stackrel{酸性KMnO_{4}溶液}{→}$
$\stackrel{酸性KMnO_{4}溶液}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、H+、Cl-、CO32- | B. | H+、Ba2+、OH-、SO42- | ||
| C. | Ba2+、K+、Cl-、NO3- | D. | Ca2+、HCO3-、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,11.2LCCl4所含的分子数为0.5NA | |
| C. | 0.5mol/LAlCl3溶液中Cl-的数目为2NA | |
| D. | 17g氨气中含有的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①所示,反应:X(g)+2Y(g)═3Z(g),b的压强一定比a大 | |
| B. | ②表明合成氨反应是放热反应,a表示在反应体系中加入了催化剂 | |
| C. | ③所示,t1℃时质量分数均为20%的甲、乙两种饱和溶液,升温到t2℃时,两种溶液中溶质的质量分数不再相等 | |
| D. | ④所示,用水稀释pH相同的盐酸和醋酸,Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com