
| A、25℃时,pH=2的1.0L H2SO4溶液中含有的H+数目为0.02NA |
| B、电解精炼铜时,当电路中转移NA个电子,阳极溶解32g铜 |
| C、2.24LNH3中含共价键数目一定为0.3NA |
| D、向含有FeI2的溶液中通入适量氯气,当有1mol Fe2+被氧化时该反应转移电子的数目至少为3NA |


科目:高中化学 来源: 题型:
| A、金属原子只有还原性,离子只有氧化性 |
| B、金属元素在化合物中一定显正价 |
| C、金属元素在不同的化合物中的化合物中的化合价均不同 |
| D、金属单质在常温下均是固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
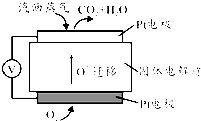
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属镁变为镁离子时失去的电子数为2NA |
| B、1molHCl气体中的粒子数与0.5 mo1/L盐酸中溶质粒子数相等 |
| C、在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10 NA |
| D、CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,56g乙烯和丙烯的混合气中含有的碳原子数为4NA |
| B、156g Na2O2固体与足量的二氧化碳反应时,转移的电子数为4NA |
| C、将1.06克Na2CO3固体溶于水,溶液中含CO32-数目为0.01NA |
| D、标准状况下,向溶有2.24LSO2的水溶液中,通入3.36LCl2,转移电子数目0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水玻璃、漂白粉、胆矾均为混合物 |
| B、生成盐和水的反应一定是中和反应 |
| C、NaOH、MgC12、NaC1O、NH4C1均为含共价键的离子化合物 |
| D、煤经过气化或液化两类化学变化过程,可变为清洁能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL 0.5mol?L-1 MgCl2溶液 |
| B、200mL 0.25mol?L-1 AlCl3溶液 |
| C、50mL 1mol?L-1 NaCl溶液 |
| D、25mL 0.5mol?L-1 HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
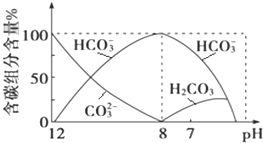 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.| c(CH3COO-).c(H+) |
| c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com