
�Ͻ�������Ͼ�����������������ܣ���������ܵĿ���������Ҫ���á�
��1��һ���¶��£�ij����Ͻ�M�������������ͼ��ʾ������Ϊƽ��ʱ������ѹǿ��p���������ʾ��������ԭ�������ԭ�ӵĸ����ȣ�H/M����
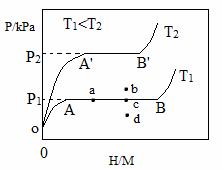
��OA�Σ����ܽ���M���γɹ�����MHx����������ѹǿ������H/M���������AB�Σ�MHx�����������⻯��Ӧ�����⻯��MHy���⻯��Ӧ����ʽΪ��zMHx(s)+H2(g)==ZMHy(s) ��H(��)����B�㣬�⻯��Ӧ��������һ����������ѹǿ��H/M�������䡣��Ӧ������z=_____���ú�x��y�Ĵ���ʽ��ʾ�����¶�ΪT1ʱ��2gij�Ͻ�4min����������240mL����������v=______mL•g-1•min����Ӧ���ʱ��H��_____0���>����<����=������
��2���DZ�ʾ��λ��������Ͻ����⻯��Ӧ�ε����������ռ�����������ı��������¶�ΪT1��T2ʱ������T1��____����T2�����>����<����=����������Ӧ������ͼ��a��ʱ�������¶Ȳ��䣬�������ϵ��ͨ�������������ﵽƽ���Ӧ�����ܴ���ͼ�е�_____�㣨�b����c����d������������Ͻ��ͨ��______��_______�ķ�ʽ�ͷ�������
��3������Ͻ�ThNi5�ɴ���CO��H2�ϳ�CH4�ķ�Ӧ���¶�ΪTʱ���÷�Ӧ���Ȼ�ѧ����ʽΪ_________����֪�¶�ΪTʱ��CH4(g)+2H2O=CO2(g)+4H2(g) ��H=+165KJ•mol
CO(g)+H2O(g)=CO2(g)+H2(g) ��H=-41KJ•mol
���𰸡���1��2/(y��x)��30��<
��2��>��c������ ��ѹ
��3��CO(g)+3H2(g)=CH4(g)+H2O(g) ∆H=��206kJ•mol‾1
����������1������Ԫ���غ�ɵ�z•x+2=z•y�����z=2/(y��x)����������v=240mL��2g��4min=30 mL•g-1•min-1����ΪT1<T2��T2ʱ������ѹǿ��˵�����������������ķ����ƶ����淴ӦΪ���ȷ�Ӧ����������ӦΪ���ȷ�Ӧ����∆H1 < 0��
��2������ͼ���֪����������ͬ������ԭ�������ԭ�ӵĸ�������ͬʱ��T2ʱ������ѹǿ��˵��T2ʱ�������٣�������T1��>����T2��������ͼ��a��ʱ�������¶Ȳ��䣬�������ϵ��ͨ����������������ѹǿ������H/M���������ͼ����ܴ���c�㣻����ƽ���ƶ�ԭ��������ͨ�����ȣ�ʹ�¶������Сѹǿʹƽ�������ƶ����ͷ�������
��3��д����ѧ����ʽ��ע��״̬��CO(g)+3H2(g)=CH4(g)+H2O(g)��Ȼ����ݸ�˹���ɿɵø÷�Ӧ��∆H=��∆H1+∆H2=��206kJ•mol‾1�������ó��Ȼ�ѧ����ʽ��
�����㶨λ�������ԺϽ��������Ϊ������������Ԫ���غ��Ӧ�á���ѧ��Ӧ���ʵļ��㡢�ʱ���жϡ���ѧƽ���ƶ���Ӱ�����ء��Ȼ�ѧ����ʽ����д��
����ʦ�㾦�������ز�ѡȡ��ӱ����ѧ��Ӧ�����뻯ѧƽ����ȫΧ��ͼ��չ�������Ҫ�������н�ǿ�Ķ�ͼ�������ܹ����ٵĴ�ͼ���еõ����õ����ݣ��ǽ����Ĺؼ�������ڶ�С��Ϊ���µ����ͣ�������һ���µ�İ�������������ҶԸ����������з��������Ҫ�����Ƕ�ƽʱ��ѧ֪ʶ�����������⡢��ѧ���ã��� ��˳���Ľ�𣬵�3С��Ϊ�Ȼ�ѧ����ʽ����д��Ϊ������Ŀ��ֻҪ����ע�������š����ʵ�״̬�Լ���ֵ�ļ���ȣ����ɵõ���ȷ�𰸡�
��˳���Ľ�𣬵�3С��Ϊ�Ȼ�ѧ����ʽ����д��Ϊ������Ŀ��ֻҪ����ע�������š����ʵ�״̬�Լ���ֵ�ļ���ȣ����ɵõ���ȷ�𰸡�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����һƿ���ʼ��ҵĻ�����֪���ҵ�ijЩ�������£�
| ���� | ����ʽ | �۵�/�� | �е�/�� | �ܶ�/(g/cm3) | ˮ���ܽ��� |
| �� | C3H6O2 | ��98 | 57.5 | 0.93 | ���� |
| �� | C4H8O2 | ��84 | 77 | 0.90 | ���� |
�ݴˣ������һ���������ѷ�����(����)
A����ȡ�� B�������� C������ D����Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£���������������ʵ���Ũ�ȵ�NH4HCO3��NaCl��Һ��ϣ���������NaHCO3���壬���ˣ�������ҺpH<7�����й�����Һ�е�����Ũ�ȹ�ϵ����ȷ���ǣ� ��
A��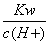 <1.0��10-7mol/L
<1.0��10-7mol/L
B��c(Na+)= c(HCO3��)+ c(CO32��)+ c(H2CO3)
C��c(H+)+c(NH4+)= c(OH��)+ c(HCO3��)+2 c(CO32��)
D��c(Cl��)> c(NH4+)> c(HCO3��)> c(CO32��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij�¶��£���2L���ܱ������У�����1molX��g����2molY��g��������Ӧ��X��g��+m Y��g��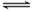
 3Z��g����ƽ��ʱ��X��Y��Z����������ֱ�Ϊ30%��60%��10%���ڴ�ƽ����ϵ�м���1molZ��g�����ٴδﵽƽ���X��Y��Z������������䡣������������ȷ���ǣ� ��
3Z��g����ƽ��ʱ��X��Y��Z����������ֱ�Ϊ30%��60%��10%���ڴ�ƽ����ϵ�м���1molZ��g�����ٴδﵽƽ���X��Y��Z������������䡣������������ȷ���ǣ� ��
A��m=2
B������ƽ���ƽ�ⳣ����ͬ
C��X��Y��ƽ��ת����֮��Ϊ1:1
D���ڶ���ƽ��ʱ��Z��Ũ��Ϊ0.4 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���Ǻϳ����ᡢ��κ͵��ʵĻ���ԭ�ϣ��ش��������⣺
��1������ˮ��Һ�������ԣ���ԭ��Ϊ �������ӷ���ʽ��ʾ����0��1 mol��L-1�İ�ˮ�м���������NH4Cl���壬��Һ��PH ������ߡ����͡�������������������������Һ�е�NH4+��Ũ�� �������С������
 ��2������識��ȷֽ�ɵõ�N2O��H2O��250��ʱ����������ܱ������зֽ�ﵽƽ�⣬�÷ֽⷴӦ�Ļ�ѧ����ʽΪ ��ƽ�ⳣ������ʽΪ ������1mol�������ȫ�ֽ⣬ת�Ƶĵ�����Ϊ mol��
��2������識��ȷֽ�ɵõ�N2O��H2O��250��ʱ����������ܱ������зֽ�ﵽƽ�⣬�÷ֽⷴӦ�Ļ�ѧ����ʽΪ ��ƽ�ⳣ������ʽΪ ������1mol�������ȫ�ֽ⣬ת�Ƶĵ�����Ϊ mol��
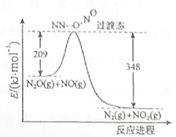
��3����N2O��NO��Ӧ����N2��NO2�������仯��ͼ��ʾ��������1molN2�� ���H= kJ��mol-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�״�����Ҫ�Ļ���ԭ�ϣ��ֿɳ�Ϊȼ�ϡ����úϳ�������Ҫ�ɷ�ΪCO��CO2��H2���ڴ����������ºϳɼ״�������������Ӧ���£�
��CO(g)+2H2(g) CH3OH(g) ��H1
CH3OH(g) ��H1
��CO2(g)+3H2(g) CH3OH��g��+H2O(g) ��H2
CH3OH��g��+H2O(g) ��H2
��CO2(g)+H2(g) CO(g)+H2O(g) ��H3
CO(g)+H2O(g) ��H3
�ش��������⣺
��1����֪��Ӧ���е���صĻ�ѧ�������������£�
| ��ѧ�� | H��H | C��O | C | H��O | C��H |
| E/��kJ.mol-1�� | 436 | 343 | 1076 | 465 | 413 |
�ɴ˼����H1�� kJ��mol-1����֪��H2��-58kJ��mol-1�����H3�� kJ��mol-1��
��2����Ӧ�ٵĻ�ѧƽ�ⳣ��K�ı���ʽΪ ��ͼ1�� ����ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ �������߱����ĸ�������ж������� ��
����ȷ��ӳƽ�ⳣ��K���¶ȱ仯��ϵ������Ϊ �������߱����ĸ�������ж������� ��

��3���ϳ��������n(H2)/n(CO+CO2)��2.60ʱ����ϵ�е�COƽ��ת���ʣ��������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ2��ʾ������CO��ֵ���¶����߶� �������С��������ԭ���� ��ͼ2�е�ѹǿ�ɴ�СΪ_____�����ж�������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
16.8g NaHCO3��7.8g Na2O2���ܱ����������գ���ַ�Ӧ���ܱ����������¶�Ϊ500�森��������ڵ������ǣ���
| A�� | Na2CO3��Na2O2��O2 | B�� | Na2CO3��O2��H2O��g�� | |
| C�� | Na2CO3��CO2��O2��H2O��g�� | D�� | NaHCO3��Na2CO3��O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��֪��1��105 Pa��298 K�����£�2 mol����ȼ������ˮ�����ų�484 kJ�����������Ȼ�ѧ����ʽ��ȷ����(����)
A��H2O(g)===H2(g)��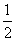 O2(g) ��H����242 kJ��mol��1
O2(g) ��H����242 kJ��mol��1
B��2H2(g)��O2(g)===2H2O(l) ��H����484 kJ��mol��1
C��H2(g)��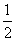 O2(g)===H2O(g) ��H����242 kJ��mol��1
O2(g)===H2O(g) ��H����242 kJ��mol��1
D��2H2(g)��O2(g)===2H2O(g) ��H����484 kJ��mol��1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com