分析:1molA充分燃烧后,生成4molCO
2和3molH
2O,A分子中含有4个碳原子、6个氢原子,而二氧化碳、水的总质量比A增加96g,增加为氧原子质量,物质的量为
=6mol,设A分子中氧原子数目为n,则4mol×2+3mol-nmol=6mol,故n=5,则A分子式为C
4H
6O
5,不饱和度为
=2,结合A的电离平衡常数,可知A为二元弱酸,1mol A与足量的金属钠反应产生1.5mol H
2,则A分子中含有一个羟基和二个羧基,核磁共振氢谱表明A分子有5个吸收峰,则A的结构简式为:HOOCCH(OH)CH
2COOH,E在氢氧化钠水溶液、加热条件下发生水解反应、酸化得到A,故E为HOOCCH(Cl)CH
2COOH,由A与B的相对分子质量可知,A发生消去反应生成B为HOOCCH=CHCOOH,B与溴发生加成反应生成C为HOOCCH(Br)CH(Br)COOH,结合D的分子式可知,C在氢氧化钠醇溶液、加热条件下发生消去反应,再酸化得到D为HOOCC≡CCOOH,据此解答.
解答:
解:1molA充分燃烧后,生成4molCO
2和3molH
2O,A分子中含有4个碳原子、6个氢原子,而二氧化碳、水的总质量比A增加96g,增加为氧原子质量,物质的量为
=6mol,设A分子中氧原子数目为n,则4mol×2+3mol-nmol=6mol,故n=5,则A分子式为C
4H
6O
5,不饱和度为
=2,结合A的电离平衡常数,可知A为二元弱酸,1mol A与足量的金属钠反应产生1.5mol H
2,则A分子中含有一个羟基和二个羧基,核磁共振氢谱表明A分子有5个吸收峰,则A的结构简式为:HOOCCH(OH)CH
2COOH,E在氢氧化钠水溶液、加热条件下发生水解反应、酸化得到A,故E为HOOCCH(Cl)CH
2COOH,由A与B的相对分子质量可知,A发生消去反应生成B为HOOCCH=CHCOOH,B与溴发生加成反应生成C为HOOCCH(Br)CH(Br)COOH,结合D的分子式可知,C在氢氧化钠醇溶液、加热条件下发生消去反应,再酸化得到D为HOOCC≡CCOOH,
(1)由上述分析可知,A的分子式为C
4H
6O
5,结构简式为:HOOCCH(OH)CH
2COOH,含有官能团为羧基、羟基,故答案为:C
4H
6O
5;羧基、羟基;
(2)反应①是A醇发生的消去反应生成B,反应②是碳碳双键与溴发生的加成反应,反应③是卤代烃的消去反应,反应条件是:氢氧化钠醇溶液、加热,故答案为:消去反应;加成反应;氢氧化钠醇溶液、加热;
(3)由于上述分析可知,D的结构简式为:HOOCC≡CCOOH,故答案为:HOOCCHHOOCC≡CCOOH;
(4)反应⑤的化学方程式为:HOOCCH(Cl)CH
2COOH+3NaOH
NaOOCCH(OH)CH
2COONa+NaCl+2H
2O,
故答案为:HOOCCH(Cl)CH
2COOH+3NaOH
NaOOCCH(OH)CH
2COONa+NaCl+2H
2O;
(5)在催化剂作用下,HOOCCH=CHCOOH与乙二醇可发生缩聚反应,生成的高分子化合物用于制造玻璃钢.该反应的化学方程式为:n

+n HOCH
2CH
2OH

+(2n-1)H
2O,
故答案为:n

+n HOCH
2CH
2OH

+(2n-1)H
2O;
(6)有机物F是A的同分异构体:它的核磁共振氢谱有2组峰,峰面积之比为1:2;它的红外光谱表明没有连氧(如“-O-O-”等)、碳碳双键红外吸收峰,符合条件的F的结构简式有:HOOCCH
2OCH
2COOH、
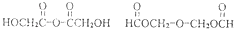
,故答案为:3;HOOCCH
2OCH
2COOH等.

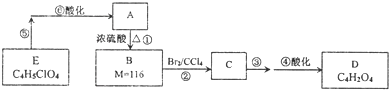
 +n HOCH2CH2OH
+n HOCH2CH2OH +(2n-1)H2O,
+(2n-1)H2O, +n HOCH2CH2OH
+n HOCH2CH2OH +(2n-1)H2O;
+(2n-1)H2O;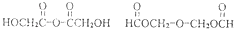 ,故答案为:3;HOOCCH2OCH2COOH等.
,故答案为:3;HOOCCH2OCH2COOH等.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
 )和邻羟基苯甲醛(
)和邻羟基苯甲醛(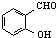 )的沸点
)的沸点 如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.