下列说法正确的是( )
A.2.24LCO2中含有的原子数为0.3×6.02×1023
B.1.8gNH4+含有的质子数为6.02×1023
C.30g乙酸和甲酸甲酯的混合物中含有的共价键数为4×6.02×1023
D.7.8gNa2O2中含有的阴离子数为0.2×6.02×1023
【答案】
分析:A、依据气体摩尔体积的应用条件分析;
B、质量换算为物质的量,结合微粒计算质子数;
C、从乙酸和甲酸甲酯的摩尔质量相同,所含共价键相同分析;
D、质量换算物质的量,结合过氧化钠的结构分析计算;
解答:解:A、温度和压强未知,无法计算二氧化碳的物质的量,故A错误;
B、1.8gNH
4+的物质的量为0.1mol,所含质子数为1.1mol,故B错误;
C、乙酸和甲酸甲酯的摩尔质量相同,分子中所含共价键数相同,30g乙酸和甲酸甲酯的混合物的物质的量=

=0.5mol,1mol乙酸或甲酸甲酯分子中含有共价键为8mol,所以0.5mol混合物含有共价键为4mol,
即共价键数为4×6.02×10
23,故C正确;
D、7.8gNa
2O
2物质的量为0.1mol,含Na
+0.2mol,含O
2-0.1mol,所以含阴离子为0.1mol,即为0.1×6.02×10
23,故D错误;
故选C.
点评:本题考查了阿伏伽德罗常数的应用,主要考查气体摩尔体积的应用条件,质量换算物质的量来计算微粒数,关键是理解乙酸和甲酸甲酯的摩尔质量相同,分子中所含共价键数相同,过氧化钠中的阴离子是过氧根离子.

 =0.5mol,1mol乙酸或甲酸甲酯分子中含有共价键为8mol,所以0.5mol混合物含有共价键为4mol,
=0.5mol,1mol乙酸或甲酸甲酯分子中含有共价键为8mol,所以0.5mol混合物含有共价键为4mol,


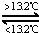 Sn(s,白)△H3=+2.1kJ?mol-1,
Sn(s,白)△H3=+2.1kJ?mol-1,