
分析 (1)Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)均为电解质;
(2)容量瓶只能配制溶液;
(3)根据m=nM计算二者质量之比,由N=nNA可知,分子数目之比等于物质的量之比;氧气所含氧原子数目为氧气分子2倍,臭氧所含氧原子数目为臭氧分子的3倍;
(4)①CCl4和H2O分层;
②碳酸钙不溶于水;
③碳酸钙高温分解生成CaO;
④碘不易溶于水,易溶于有机溶剂;
⑤四氯化碳、甲苯互溶,但沸点不同.
解答 解:(1)Ba(OH)2(固体)、CuSO4(固体)、CH3COOH(液态)均为电解质,而硝酸钠属于电解质,75%的酒精溶液、Fe(OH)3胶体、豆浆均为混合物,
故答案为:硝酸钠;
(2)容量瓶只能配制溶液,蒸馏烧瓶用于蒸馏分离,漏斗用于过滤分离,分液漏斗用于分液分离,故答案为:容量瓶;
(3)根据m=nM可知,相同物质的量的O2和O3的质量之比=32g/mol:48g/mol=2:3,由N=nNA可知,分子数目之比等于物质的量之比=1:1;氧气所含氧原子数目为氧气分子2倍,臭氧所含氧原子数目为臭氧分子的3倍,故相同物质的量的O2和O3含有氧原子数目之比=1×2:1×3=2:3,
故答案为:2:3;1:1;2:3;
(4)①CCl4和H2O分层,则选择分液法分离,故答案为:A;
②碳酸钙不溶于水,则选择过滤法分离,故答案为:B;
③碳酸钙高温分解生成CaO,则选择加热法分离,故答案为:F;
④碘不易溶于水,易溶于有机溶剂,则选择萃取法,故答案为:C;
⑤四氯化碳、甲苯互溶,但沸点不同,则选择蒸馏法分离,故答案为:D.
点评 本题考查混合物的分离提纯,为高频考点,把握物质的分类、仪器的使用、物质的性质及混合物分离方法选择为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
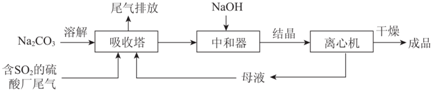
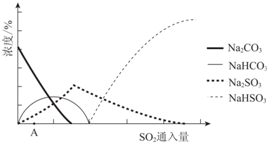
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 | |
| D. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为黄色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| ② | 在FeCl2溶液中加入锌片 | (不写) | Zn+Fe2+=Zn2++Fe | Fe2+具有氧化性 |
| ③ | 在FeCl3溶液中加入足量铁粉 | 溶液由黄色变为浅绿色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ④ | 在FeCl3溶液中滴入适量KI溶液和淀粉溶液 | 变蓝色 | 2Fe3++2I-=2Fe2++I2 | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
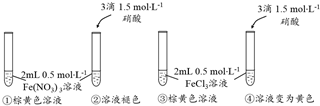
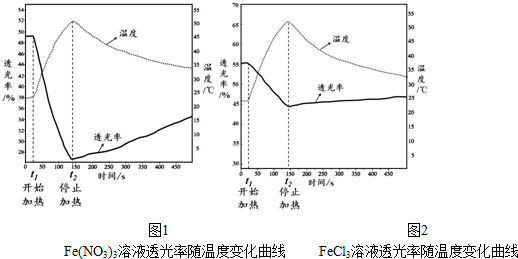
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
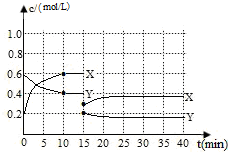 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com