
| A、2H2S+SO2=3S+2H2O中,氧化产物和还原产物物质的量之比为2:1 | ||||
| B、4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O中,氧化剂和还原剂物质的量之比为5:2 | ||||
C、3I2+6KOH
| ||||
D、2FeS+6H2SO4(浓)
|


科目:高中化学 来源: 题型:
| A、测0.1mol/L氨水的pH为11:NH3?H2O?NH4++OH- | ||||
| B、将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | ||||
C、用CuCl2溶液做导电实验,灯泡发光:CuCl2
| ||||
| D、Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
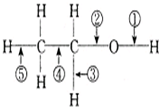 乙醇在一定条件下发生化学反应时化学键断裂如下图所示.下列说法不正确的是( )
乙醇在一定条件下发生化学反应时化学键断裂如下图所示.下列说法不正确的是( )| 反应 | 反应类型 | 断键位置 | |
| A | 乙醇与金属钠 | 置换 | ① |
| B | 乙醇/浓硫酸170℃ | 消去 | ②⑤ |
| C | 乙醇/浓氢溴酸加热 | 取代 | ① |
| 乙醇与乙酸/浓硫酸加热 | 酯化 | ① | |
| D | 乙醇/Cu Ag加热 | 催化氧化 | ①③ |
| 燃烧 | 氧化 | ①②③④⑤ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子核外M层有8个电子的元素 |
| B、原子核外L层比M层多一个电子的元素 |
| C、最高价为+7价的元素 |
| D、原子最外层电子数为2的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH3CH3+Cl2
| ||
| B、由油脂得到甘油,由淀粉得到葡萄糖;均发生了水解反应 | ||
| C、Cl2+2Br-═2Cl-+Br2,Zn+Cu2+═Zn2++Cu,均为单质被还原的置换反应 | ||
| D、2Na2O2+2H2O═4NaOH+O2↑,Cl2+H2O═HCl+HClO,均为水作还原剂的氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和② | B、①④和⑤ |
| C、①和⑤ | D、②和⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、复合材料保持了原材料的优点,又有优于原材料的特点 |
| B、玻璃钢是一种新型合金材料,其强度和韧性都强于钢铁 |
| C、“神六”飞船使用了大量的复合材料 |
| D、铜是一种有色金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.
(1)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂过氧化氢,当它们混合时,即产生大量氧气和水蒸气,并放出大量热.已知0.4mol液态肼与足量过氧化氢反应,生成氮气和水蒸气,放出256.65kJ的热量.| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com