
下列有关实验装置进行的相应实验,能达到实验目的的是
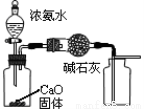
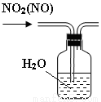
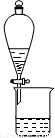
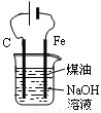
图1 图2 图3 图4
A.用图1装置制取并收集干燥纯净的NH3
B.用图2所示装置可除去NO2中的NO
C.用图3所示装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源:2015届江苏省沭阳县高二下学期期中调研测试化学试卷(解析版) 题型:选择题
某反应过程中能量变化如下图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是

A.催化剂能降低反应的活化能
B.催化剂能改变反应的焓变(△H)
C.该反应为放热反应
D.正反应的活化能小于逆反应的活化能
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二下学期4月阶段测试化学试卷(解析版) 题型:选择题
一定条件下存在反应:A(g)+B(g)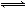 C(g)+D(g) ΔH<0。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃条件下开始反应。达到平衡时,下列说法正确的是
C(g)+D(g) ΔH<0。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 molA和1 mol B,在Ⅱ中充入1 mol C和1 mol D,在Ⅲ中充入2 mol A和2 mol B,500℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中A的物质的量比容器Ⅱ中的多
D.容器Ⅰ中A的转化率与容器Ⅱ中C的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:填空题
(18分) A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4;G+的M层电子全充满。用化学式或化学符号回答下列问题:
(1) G的基态原子的外围电子排布式为_____________________________________,在周期表中属于________区。
(2) B与F形成的一种非极性分子的电子式为_________________________;F的一种具有强还原性的氧化物分子的VSEPR模型为___________。
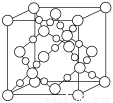
(3) BD2在高温高压下所形成的晶胞如下图所示。该晶体的类型属于______(选填“分子”、“原子”、“离子”或“金属”)晶体。
(4) 设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液
③pH=3的丙溶液,3种溶液中水电离出的c(H+)之比为________________。
(5) 丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1∶4混合后,溶液中各离子浓度大小顺序为________。
(6) A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:____________________。
(7) 往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是__。
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO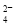 与PO
与PO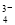 互为等电子体,空间构型均为正四面体
互为等电子体,空间构型均为正四面体
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌的新型高效的多功能水处理剂。高铁酸钾在水处理过程中涉及到的过程正确的有:
①蛋白质的变性 ②蛋白质的盐析 ③胶体的聚沉 ④盐类水解 ⑤焰色反应 ⑥氧化还原反应
A.①②③④ B.①③④⑥ C.②③④⑤ D.②③⑤⑥
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:实验题
[实验化学]苯亚甲基苯乙酮俗称查尔酮,淡黄色梭状晶体,熔点58℃,沸点208℃(3.3kp),易溶于醚、氯仿和苯,微溶于醇。制备原理如下:
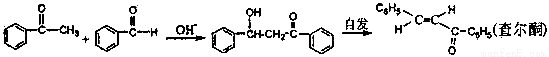

(1)制备过程中。需在搅拌下滴加苯甲酸,并控制滴加速度使反应温度维持在25~30℃,说明该反应是(填“放热”或“吸热”)反应。如温度过高时,则可采用 措施。
(2)产品结晶前,可以加入几粒成品的查尔酮,其作用是。
(3)结晶完全后,需抽滤收集产物。’抽滤装置所包含的仪器除减压系统外还有、(填仪器名称)。
(4)获得的深色粗产品加入活性炭,用95%乙醇重结晶即得查尔酮晶体,可通过法来判断原料是否反应完全以及反应的转化率和选择性。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省南京市高三9月学情调研卷化学试卷(解析版) 题型:选择题
有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg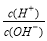 ,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( )
,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( )

A.A点时加入氢氧化钠溶液体积为20 mL
B.室温时0.01 mol·L-1的醋酸溶液pH=4
C.OA段溶液中:c(CH3COO-)> c(CH3COOH)
D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) = c(OH-) - c(H+)
查看答案和解析>>
科目:高中化学 来源:2015届广西桂林市高三上学期第一次月考化学试卷(解析版) 题型:实验题
(11分)实验室需要配制0.55mol·L-1 NaOH溶液220 mL。
按下列操作步骤填上适当的文字,以使整个操作完整。
(1) 选择仪器。完成本实验所必需的仪器有:托盘天平、药匙、烧杯、玻璃棒、______ ___ ____、__________________ 。
(2) 计算。配制该溶液需取NaOH晶体________g。
(3) 称量。
① 天平调平后,应将天平的游码调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:
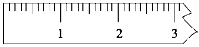
② 称量过程中NaOH晶体应放于天平的__________(填“左盘”或“右盘”)。
(4) 溶解、冷却,该步实验中需要使用玻璃棒,目的是______________________________。
(5) 转移、洗涤。在转移时应使用玻璃棒引流,应注意______
;需要洗涤烧杯2~3次是为了________________________________________________________________________。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明溶液名称、浓度及配制的时间。
(8)下列操作使所配溶液浓度偏大的有______________(填字母,下同);偏小的有_____________;
无影响的有_____________。
A 称量时用生锈的砝码 B 将NaOH放在纸上称量
C NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中 D 往容量瓶转移时有少量液体溅出
E、未洗涤溶解NaOH的烧杯 F、定容时仰视刻度线
G、容量瓶未干燥就用来配制溶液
查看答案和解析>>
科目:高中化学 来源:2015届广东省湛江市高三8月月考化学试卷(解析版) 题型:实验题
(16分)已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为了探究SO2的漂白作用到底是SO2本身还是SO2与水作用的产物,某学习小组设计了如图装置来进行实验。请回答相关问题。
(1)制备SO2气体的反应方程式为: ;
发生装置的玻璃仪器名称为 、 ;
(2)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处。
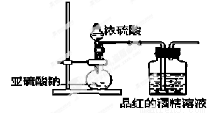
① ;② ;
(3)按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是SO2直接导致。为此,SO2能使品红的水溶液褪色的可能微粒有(不考虑水及水电离出来的粒子) 。
(4)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量Na2SO3固体和NaHSO3固体,两支试管中的品红都褪色,对此他得出结论:使品红褪色的微粒是HSO3-和SO32-,不是H2SO3。你认为他的结论是否正确 ,其理由是 。
(5)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,再分别一次性加入20ml 0.1mol/L的Na2SO3溶液、20ml 0.1mol/L的NaHSO3溶液,发现加入Na2SO3溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“ ”内容:
同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
Na2SO3溶液 | 多 | 少 | 少 | 快 |
NaHSO3溶液 | 较上面_________ | 较上面_______ | 较上面_______ | 慢 |
②根据实验和分析,得出的结论是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com