
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
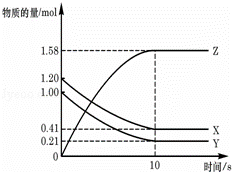
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L•s)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y转化了0.79mol
D.反应的化学方程式为:X(g)+Y(g)⇌Z(g)
考点:化学平衡的计算;化学平衡的影响因素.
专题:化学平衡专题.
分析:根据图象知,随着反应的进行,X、Y的物质的量减小,Z的物质的量增加,说明X、Y是反应物,Z是生成物,达到平衡时△n(X)=(1.20﹣0.41)mol=0.79mol,△n(Y)=(1.00﹣0.21)mol=0.79mol,△n(Z)=(1.58﹣0)mol=1.58mol,同一反应中同一时间段内各物质的物质的量变化之比等于其计量数之比,所以
X、Y、Z的计量数之比=1:1:1,则该反应方程式为X(g)+Y(g)⇌2Z(g),
A.反应开始到10s,用Z表示的反应速率= =
= ;
;
B.反应开始到10s,X的物质的量浓度减少了 ;
;
C.反应开始到10s时,Y转化了(1.00﹣0.21)mol;
D.同一反应方程式中同一时间段内各物质的物质的量变化之比等于其计量数之比.
解答: 解:根据图象知,随着反应的进行,X、Y的物质的量减小,Z的物质的量增加,说明X、Y是反应物,Z是生成物,达到平衡时△n(X)=(1.20﹣0.41)mol=0.79mol,△n(Y)=(1.00﹣0.21)mol=0.79mol,△n(Z)=(1.58﹣0)mol=1.58mol,同一反应中同一时间段内各物质的物质的量变化之比等于其计量数之比,所以
X、Y、Z的计量数之比=1:1:1,则该反应方程式为X(g)+Y(g)⇌2Z(g),
A.反应开始到10s,用Z表示的反应速率= =
= =
= =0.079mol/(L•s),故A错误;
=0.079mol/(L•s),故A错误;
B.反应开始到10s,X的物质的量浓度减少了 =0.395mol/L,故B错误;
=0.395mol/L,故B错误;
C.反应开始到10s时,Y转化了(1.00﹣0.21)mol=0.79mol,故C正确;
D.通过以上分析知,该反应方程式为X(g)+Y(g)⇌2Z(g),故D错误;
故选C.
点评:本题考查图象分析,涉及方程式的确定、物质的量及物质的量浓度和反应速率的计算,熟练掌握基本公式及方程式中物质的量变化量与计量数的关系,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
用所学知识回答问题:
(1)浓硝酸久置常会显黄色,是因为 (用化学反应方程式表示),可采用 的方法消除黄色.
(2)酸性高锰酸钾溶液的氧化性比普通高锰酸钾的氧化性强,酸化时所用的酸为 ,向酸性KMnO4溶液中加入KI溶液,溶液紫红色褪去(所得溶液可使淀粉溶液变蓝),请写出KMnO4溶液褪色的离子方程式
(3)硫化氢的水溶液久置于空气中会变浑浊,请写出相关的化学反应方程式
(4)配平下面的化学方程式: Cu2O+ HNO3→ Cu(NO3)2+ NO↑+ H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度不变、恒容的容器中进行反应A⇌2B,若反应物A的浓度由0.1mol/L降到 0.06mol/L需20s,那么再由0.06mol/L降到0.04mol/L需反应的时间为( )
A.10s B.8s C.大于10s D.小于10s
查看答案和解析>>
科目:高中化学 来源: 题型:
电子计算器中所用的纽扣电池为银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液.电极反应式为:Zn+2OH﹣﹣2e﹣═Zn(OH)2、Ag2O+H2O+2e﹣═2Ag+2OH﹣下列叙述中,正确的是( )
A.电流由锌经外电路流向氧化银
B.锌是正极,氧化银是负极
C.工作时,负极区溶液pH减小,正极区pH增大
D.溶液中OH﹣向正极移动,K+、H+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
有关碰撞理论,下列说法中不正确的是( )
A.具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应
B.增大反应物浓度,单位体积内活化分子数增多,有效碰撞几率增大,反应速率增大
C.升高温度,活化分子百分数增大,有效碰撞的几率增大,反应速率增大
D.正催化剂能降低反应的活化能,提高活化分子百分数,有效碰撞的几率增大,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应:2CH3COCH3(l)⇌CH3COCH2COH(CH3)2(l).取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y﹣t)如图所示.下列说法正确的是( )

A.b代表0℃下CH3COCH3的Y﹣t曲线
B.反应进行到20min末,CH3COCH3的
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
B.常温下,pH =12的Na2CO3溶液中含有的OH-离子数为0. 01NA
C.标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA
D.7.8 g Na2O2中含有的阴离子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比可能是( )
A. 9:4 B. 1:1 C. 7:6 D. 6:7
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质与应用均正确的是
A.Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒
B.乙烯能使溴水和酸性高锰酸钾溶液褪色,且褪色原理相同
C.Mg(OH)2难溶于水,但可缓慢溶于浓的NH4Cl溶液
D.油脂在酸性条件下可以水解,可用此反应可以制作肥皂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com