
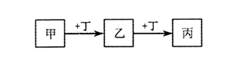
| A.若甲是AlCl3溶液,则丁可能是NaOH溶液 |
| B.若甲是Fe,则丁可能是Cl2 |
| C.若丁是CO2,则甲可能为Mg |
| D.若丁是O2,则乙、丙的相对分子质量可能相差16 |
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源:不详 题型:单选题
| | 化学事实 | 类推结论 |
| A | pH=3的盐酸稀释1000倍后pH=6 | pH=6的盐酸稀释1000倍后pH=9 |
| B | 用电解熔融MgCl2的方法冶炼金属镁 | 用电解熔融NaCl的方法冶炼金属钠 |
| C | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| D | Al在O2中燃烧生成Al2O3 | Fe在O2中燃烧生成Fe2O3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 浓H2SO4有吸水性 | 浓H2SO4可用于干燥氨气 |
| B | SO2有氧化性 | SO2尾气可用NaOH溶液吸收 |
| C | Mg有还原性 | 电解MgCl2饱和溶液可制备Mg |
| D | NH3和HCl在水中溶解度很大 | 充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝合金的熔点比纯铝高 |
| B.电解MgCl2溶液可获得金属镁 |
| C.水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
| D.铜具有良好的导电性,常用来制作印刷电路板 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
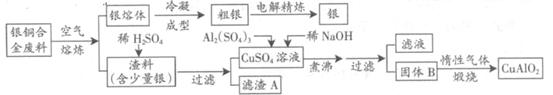
 CuAlO2 + ↑。
CuAlO2 + ↑。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
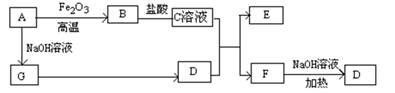
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
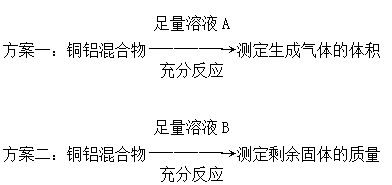
| A.溶液A和溶液B均可以是盐酸或NaOH溶液 |
| B.若溶液B选用浓硝酸,测得铜的质量分数偏大 |
| C.方案一可能产生氢气,方案二可能剩余铜 |
| D.实验室中方案Ⅱ更便于实施 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
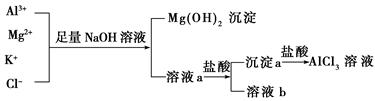
| A.NaOH溶液可以用氨水来代替 |
| B.溶液a只含有Al3+、K+、Cl-、Na+、OH- |
| C.溶液b中只含有NaCl |
| D.向溶液a中滴加盐酸需控制溶液的pH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com