
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。
元素信息
B其单质在常温下为双原子分子,与A可形成分
子X,X的水溶液呈碱性
D其简单阳离子与X具有相同电子数,且是同周
期中简单阳离子中半径最小的
E元素原子最外层比次外层少2个电子
C、F两种元素的原子最外层共有13个电子
则:(1)B的原子结构示意图为 。
(2)B、C、E分别与A形成的化合物中最稳定的是 (写化学式)。
(3)C与D形成的化合物的化学式是 ,它的性质决定了它在物质的分类中应属于 ;请写出该化合物对应水化物电离的方程式 。
(4)F的单质在反应中常作 剂,该单质的水溶液与E的低价氧化物反应的离子方程式 。
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-2练习卷(解析版) 题型:填空题
一定条件下,体积为1 L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)  SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
SiO2(s)+4HF(g) ΔH=+148.9 kJ·mol-1。
(1)下列各项中能说明该反应已达化学平衡状态的是________(填字母序号)。
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示。
反应时间/min | n(SiF4)/mol | n(H2O)/mol |
0 | 1.20 | 2.40 |
t1 | 0.80 | a |
t2 | b | 1.60 |
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:________。
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应________(填序号)。
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-3练习卷(解析版) 题型:填空题
已知X元素原子的K、L层的电子数之和比L、M层的电子数之和多1个电子。Y元
素的原子最外层电子数比内层电子数少3个。Z元素核外有3个电子层,最外层有3个电子。W元素最高化合价是最低化合价绝对值的3倍,它在最高价氧化物中的质量分数为40%。
(1)Y和W的气态氢化物的稳定性为(用化学式表示) > 。
(2)X单质在空气中加热生成的化合物是 化合物(填“离子”或“共价”)。
(3)X和Z的最高价氧化物对应水化物反应的离子方程式 。
(4)W的低价氧化物与Y单质的水溶液反应的化学方程式 。
(5)Y与Z形成化合物的化学式是 。实验测得当此化合物处于固态和液态时不导电,溶于水能导电。由此判断该化合物具有 键(填“离子”或“共价”)。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-2练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.P和S属于第三周期元素,P原子半径比S小
B.同周期ⅡA和ⅢA族元素的原子序数都相差1
C.短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则原子序数、原子半径和单质的还原性都按照A、B、C、D的顺序减小
D.Cl和Br属于第ⅦA族元素,HClO4酸性比HBrO4强。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-2练习卷(解析版) 题型:选择题
下列各组中的性质比较,不正确的是( )
A.稳定性:NH3<PH3<SiH4
B.酸性:HClO4>H2SO4>H3PO4
C.碱性:KOH>NaOH>Mg(OH)2
D.还原性:F-<Cl-<Br-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-1练习卷(解析版) 题型:选择题
X、Y、Z均为短周期元素。已知X元素的某种原子核内无中子,Y元素的原子核外最外层电子数是其次外层电子数的2倍,Z元素是地壳中含量最丰富的元素。有下列含这三种元素的化学式:
①X2Y2Z2;②X2YZ3;③X2YZ2;④X2Y2Z4;⑤X3YZ4;⑥XYZ3,其中可能存在的是( )
A.② B.②④⑤ C.②⑤⑥ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-4练习卷(解析版) 题型:填空题
硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:
。
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。
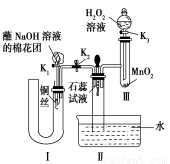
①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至 后,迅速关闭K1,观察到U形管内的现象是 。
②装置Ⅲ中发生反应的化学方程式为 。
③蘸NaOH溶液的棉花团的作用是 。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练4-3练习卷(解析版) 题型:填空题
浓硫酸具有以下A~F的性质:A酸性;B高沸点难挥发;C吸水性;D脱水性;E强氧化性;F溶于水放出大量热
(1)浓硫酸与铜共热发生反应的化学方程式为 。实验中往往有大量蓝色固体析出,可见浓硫酸在该实验中表现的性质有 。(浓硫酸性质用“A”、“B”、“C”、“D”、“E”、“F”填空,下同)
(2)实验证明铜不能在低温下与O2反应,也不能与稀硫酸共热发生反应,但工业上却是将废铜屑倒入热的稀硫酸中并通入空气来制备CuSO4溶液。铜屑在此状态下被溶解的化学方程式为 。硫酸在该反应中表现的性质是 。
(3)在过氧化氢与稀硫酸的混合溶液中加入铜片,常温下就生成蓝色溶液。写出有关反应的化学方程式: 。与(2)中反应比较,反应条件不同的原因是 。
(4)向蔗糖晶体中滴2~3滴水,再滴入适量的浓硫酸。发现加水处立即变黑,黑色区不断扩大,最后变成一块疏松的焦炭,并伴有刺激性气味的气体产生。写出产生有刺激气味气体的化学方程式: 。该实验中浓硫酸表现的性质有 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练3-4练习卷(解析版) 题型:填空题
利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废
铜粉制备硫酸铜晶体。生产过程如下:
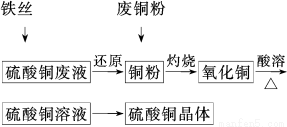
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有______________________________________________
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因可能是:
①灼烧不充分Cu未被完全氧化。
②CuO被还原。还原剂可能是________,该反应的化学方程式是___________________
(3)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示)____________________。
(4)直接向氧化铜混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是__________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com