
能在水溶液中大量共存的一组离子是
A.H+、Ca2+、I-、NO3- B.Al3+、Mg2+、SO42-、CO32-
C.NH4+、Na+、Br-、SO42- D.K+、Fe2+、OH-、HCO3-
科目:高中化学 来源:2014-2015湖北宜昌市高二3月月考化学试卷(解析版) 题型:填空题
(12分)有机物键线式结构的特点是以线示键,每个折点和线端处表示有一个碳原子,并以氢补足四键,C、H不表示出来,其它原子或原子团要表示出来,例如:CH3CHOHCH3的键线式结构为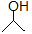 。CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为
。CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为 。
。
(1)CH3CH=CHCH3的名称为 ,其所含官能团的结构式为 ,与H2在一定条件下发生加成反应,其产物的同分异构体的键线式结构为 。
(2)完成下列反应方程式,产物用键线式表示: +Br2→ ,反应类型为 反应。
+Br2→ ,反应类型为 反应。
(3) 是一种加聚产物,则其单体的结构简式为 ,其链节为 。
是一种加聚产物,则其单体的结构简式为 ,其链节为 。
(4)写出与CH3CH=CHCH3含有相同官能团的同分异构体的结构简式 。(任写一种)
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:填空题
(14分)红磷P(s)和Cl2 (g)发生反应生成PCl3(g)和 PCl5(g),反应过程如下。
2P(s) + 3Cl2(g) = 2PCl3(g) △H=-612kJ/mol
2P(s) + 5Cl2(g) = 2PCl5(g) △H=-798kJ/mol
请回答下列问题。
(1)气态 PCl5生成气态PCl3和Cl2的热化学方程式为 。
(2)PC15生成 PCl3和Cl2是一个可逆反应,向5.0L密闭容器中充入0.1 md PCl5(g),反应在不同条件下进行,反应体系总压强随时间的变化关系如图所示。
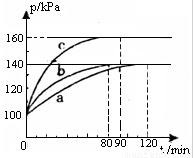
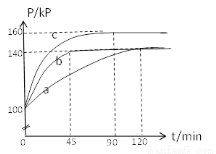
①实验b中PCl5的平衡分解率为 ,其他条件不变,在该实验中再加入 0.1 mol PCl5 (g) ,平衡分解率 (填“增大”、“减小”或“不变”)。
②与实验a相比,c改变的条件是 ,判断依据是 。
(3)PCl5露置于潮湿空气中,能水解生成两种中学化学常见酸,其化学方程式为 。
(4)人的牙齿表面有一层釉质,其组成为羟基磷灰石 Ca5( PO4)3OH(Ksp=6.8×10-37)。为了防止蛀牙,人们常使用含氟离子的牙膏,其中的氟化物可使轻基磷灰石转化为氟磷灰石Ca5( PO4)3F(Ksp=1.0×10-60)。写出该反应的离子方程式 ,该反应的平衡常数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖北省襄阳市高二3月月考化学试卷(解析版) 题型:选择题
下列叙述中,正确的是
A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
D.某基态原子错误的核外电子排布图为 该排布图违背了泡利原理
该排布图违背了泡利原理
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省梅州市高三高三总复习质检理综化学试卷(解析版) 题型:选择题
(双选)下列根据实验和现象所得出的结论正确的是
选项 | 实验 | 现象[来 | 结论 |
A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
B | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X中一定含有SO42- |
C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色胶状物 | 酸性:H2SiO3<H2CO3 |
D | 向浓度均为0.1mol/LNaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | KSP(AgCl) > KSP(AgI) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:填空题
(8分)
Ⅰ.醋酸是常见的弱酸。用0.1 molL—1NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 molL—1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH体积而变化的两条滴定曲线。

(1)滴定醋酸的曲线是 (填“I”或“Ⅱ”)。
(2)滴定开始前,三种溶液中由水电离出的c(H+)最大的溶液名称是 。
(3)V1和V2的关系:V1 V2(填“>”、“=”或“<”)
(4)M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
Ⅱ.草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O42H2O)在空气中受热的质量变化曲线,曲线中300 ℃及以上所得固体均为钴氧化物。

(1)通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225 ℃~300 ℃发生反应的化学方程式: 。
(2)取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年新疆乌鲁木齐地区高三第二次诊断性测试化学试卷(解析版) 题型:选择题
镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。如图为“镁一次氯酸盐”燃料电池示意图,电极为镁合金和铂合金。关于该电池的叙述正确的是
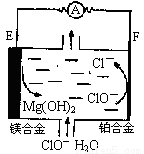
A.E为该燃料电池的正极
B.负极发生的电极反应式为ClO—+2e—+H2O=Cl—+2OH—
C.电池工作时,正极周围溶液的pH将不断变小
D.镁燃料电池负极能发生自腐蚀产生氢气,使负极利用率降低
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高三下学期第一次模考化学试卷(解析版) 题型:填空题
(14分)
(1)已知:①N2(g)+O2(g)=2NO(g) △H=+179.5 kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3 kJ/mol
③2NO(g)+2CO(g)=N2(g) +2CO2(g) △H=-759.8 kJ/mol
NO2(g)+CO(g)=NO(g) +CO2(g) △H= kJ/mol。
(2)将不同物质的量的H2O(g)和CO(g)分别通入体积为2 L的恒容密闭容器中,进行反应:H2O(g)+CO(g)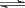 CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min[ | ||
H2O | CO | CO | H2 | |||
① | 650 | 2 | 4 | 2.4 | 1.6 | 5 |
② | 900 | 1 | 2 | 1.6 | 0.4 | 3 |
③ | 900 | a | b | c | d | t |
①实验组①中以v(CO2)表示的反应速率为 ,此温度下的平衡常数为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②650 ℃时,若在此容器中开始充入2 mol H2O(g)、 1 mol CO、 1 mol CO2和 2 mol H2,若要使反应在开始时 进行。(填“正向”、“逆向”)
③若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系为
α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市门头沟区高三3月综合练习理综化学试卷(解析版) 题型:选择题
下列解释事实的方程式正确的是
A.向AgCl沉淀中滴入饱和KI溶液反应的离子方程式:AgCl + I- = AgI + Cl-
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:Ba2++OH-+H++SO42-= BaSO4↓+H2O
C.向A1C13溶液中加入过量的氨水:Al3++4NH3·H2O = AlO2-+ 4NH4+ + 2H2O
D.向Ca(ClO)2溶液中通入适量SO2 :Ca2++2ClO-+SO2+H2O = CaSO3↓+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com