
【题目】印刷电路板(简称PCB)是电子产品的重要组成部分,在PCB的加工过程中,常采用碱性蚀刻法,蚀刻后的废液中存在大量的[Cu(NH3)4]C12,如果直接排放不仅造成资源浪费,而且污染环境。下图是碱性蚀刻制PCB,并利用蚀刻废液制碱式碳酸铜(Cu2(OH)2CO3)的工艺流程。

(1)碱性蚀刻时发生反应的化学方程式为_____________________________________。
(2)滤液a的溶质主要是__________。(化学式)
(3)不同的氨铜比和碳铜比条件下溶解CuO得A溶液,实验结果如下图。该反应的最佳实验条件为_______________________________。(氨铜比指n(NH3)∶n(CuO),碳铜比指n(NH4HCO3)∶n(CuO) )

(4)A溶液主要含[Cu(NH3)n]2+,对溶液中析出的无水碳酸盐进行分析后,测得元素质量分数为N:17.5%,Cu:39.7%,则此蓝色晶体的化学式是____________。
(5)写出真空蒸氨反应的化学方程式__________________________________________。
(6)蒸氨时,如果选择在常压80℃条件下进行,即使反应24小时,也仅有少量氨蒸出,且不Cu2(OH)2CO3沉淀析出。原因为______________________________________。
(7)除流程中标出的循环使用的物质外,还可循环使用的物质有__________。
(8)已知某次实验从0.4L 含Cu元素140g/L的蚀刻废液获得碱式碳酸铜82.5g,则Cu元素回收率为_____________(结果保留至1%)。
【答案】 2Cu + O2 + 4NH3·H2O + 4NH4Cl =2 [Cu(NH3)4]C12 + 6H2O NaCl 氨铜比3.0:1,碳铜比1.25:1 [Cu(NH3)2]CO3 2[Cu(NH3)2] CO3+ H2O == Cu2(OH)2CO3↓+ 4NH3↑ + CO2↑ 氨气极易溶于水,常压不容易蒸出,且[Cu(NH3)2]2+稳定 气体a(或NH3) 85%
【解析】(1)碱性蚀刻时,蚀刻后的废液中存在大量的[Cu(NH3)4]C12,Cu、 O2、NH3·H2O 和NH4Cl反应生成[Cu(NH3)4]C12,反应的化学方程式为2Cu + O2 + 4NH3·H2O + 4NH4Cl =2 [Cu(NH3)4]C12 + 6H2O,故答案为:2Cu + O2 + 4NH3·H2O + 4NH4Cl =2 [Cu(NH3)4]C12 + 6H2O;
(2)[Cu(NH3)4]C12中加入氢氧化钠溶液加热生成氧化铜,和气体a,气体a应该为氨气,根据质量守恒,滤液a的溶质主要是NaCl,故答案为:NaCl;
(3)根据图像,氨铜比3.0:1,碳铜比1.25:1时CuO的溶解率较高,最佳实验条件为氨铜比3.0:1,碳铜比1.25:1,故答案为:氨铜比3.0:1,碳铜比1.25:1;
(4)A溶液主要含[Cu(NH3)n]2+,对溶液中析出的无水碳酸盐进行分析后,测得元素质量分数为N:17.5%,Cu:39.7%,则n(NH3):n(Cu)=  :
: ![]() =2:1,此蓝色晶体的化学式为[Cu(NH3)2]CO3,故答案为:[Cu(NH3)2]CO3;
=2:1,此蓝色晶体的化学式为[Cu(NH3)2]CO3,故答案为:[Cu(NH3)2]CO3;
(5)根据流程图,真空蒸氨时,[Cu(NH3)2]CO3分解放出氨气,同时生成Cu2(OH)2CO3↓,反应的化学方程式为2[Cu(NH3)2] CO3+ H2O == Cu2(OH)2CO3↓+ 4NH3↑ + CO2↑,故答案为:2[Cu(NH3)2] CO3+ H2O == Cu2(OH)2CO3↓+ 4NH3↑ + CO2↑;
(6)氨气极易溶于水,常压不容易蒸出,且[Cu(NH3)2]2+稳定,因此在常压80℃条件下进行,即使反应24小时,也仅有少量氨蒸出,故答案为:氨气极易溶于水,常压不容易蒸出,且[Cu(NH3)2]2+稳定;
(7)根据流程图,气体a为氨气,滤液a的溶质主要是NaCl,氨气可以被循环使用,故答案为:气体a(或NH3);
(8)82.5g碱式碳酸铜中含有铜元素的质量=82.5g×![]() =47.41g,Cu元素回收率=
=47.41g,Cu元素回收率=![]() ×100%=85%,故答案为:85%。
×100%=85%,故答案为:85%。


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(1)甲烷的电子式是______,结构式是________,其空间构型是_______,在光照的条件下,甲烷可以和氯气发生_______反应。甲烷在空气中完全燃烧的化学方程式_________________。
(2)足球比赛中当运动员肌肉挫伤或扭伤时,队医会迅速对运动员的受伤部位喷射一种药剂——氯乙烷(沸点为12.27 ℃)进行局部冷冻麻醉应急处理。乙烷和氯气发生取代反应生成氯乙烷的反应方程式为______________________。
(3)氯乙烷用于冷冻麻醉应急处理的原理是_________。
A.氯乙烷不易燃烧 B.氯乙烷易挥发 C.氯乙烷易溶于有机溶剂 D.氯乙烷难溶于水
(4)制取CH3CH2Cl最好的方法是________。
A.乙烷与氯气反应 B.乙烯与氯气反应C.乙烷与HCl反应 D.乙烯与HCl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]() N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中,始终无明显现象的是( )
A.SO2通入Ba(NO3)2溶液中
B.O2通入Na2SO3溶液中
C.Cl2通入Na2SiO3溶液中
D.NH3通入Ca(HCO3)2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国许可使用的食盐抗结剂目前有:亚铁氰化钾、磷酸钙、二氧化硅和微晶纤维素。卫生部规定食盐中亚铁氰化[K4Fe(CN)6]的最大使用量为10mgkgˉ1.
(1)基态钾原子核外能量最高的电子所在能级的轨道数目为__________,K4Fe(CN)6中Fe2+的外围电子排布图为_________________。
(2)K4Fe(CN)6中存在_____________(填序号)。
A.离子键 B.非极性键 C.配位键 D.σ键 E.π键
(3)写出和CN-互为等电子体的离子的电子式为______________________
(4)磷酸钙中磷酸根的空间构型为______________,二氧化硅晶体中硅原子的杂化方式为_____
(5)亚铁氰化钾溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与CN-是等电子体的气态化合物,反应化学方程式为_______________。
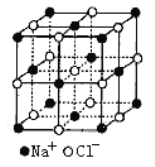
(6)FeO晶体的晶胞与NaCl的相似,NaCl的晶胞如图所示。由于晶体缺陷,某氧化亚铁晶体的实际组成为Fe0.9O,其中包含有Fe2+和Fe3+,晶胞边长为428pm,则该晶体的密度为____g/cm3 (列出计算式即可,用NA 表示阿伏伽德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧能抑制人体内磷酸盐的吸收,降低体内血清磷酸盐和磷酸钙的水平,常用于慢性肾衰患者高磷血症的治疗。某课外小组对碳酸镧的实验室制备进行了探究:
已知:ⅰ.La2(CO3)3难溶于水,易溶于盐酸,溶液pH较高时易生成碱式碳酸镧[La(OH)CO3]。
ⅱ.LaCl3与易溶的碳酸盐或碳酸氢盐反应可制备La2(CO3)3。
(1)甲组同学利用下列装置在实验室中用碳酸氢铵制备碳酸镧。
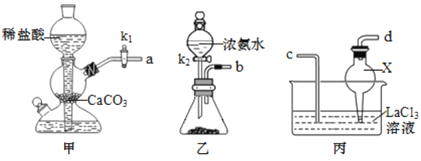
①仪器X的作用为__________;锥形瓶中可选用的试剂为__________(填化学式)。
②实验中 K1、 K2打开的先后顺序为______________;为保证碳酸镧的纯度,实验过程中需要注意的问题有_____________________。
(2)乙组同学对碳酸钠和碳酸氢钠与氯化镧反应制备碳酸镧进行了探究。
①通过实验发现用碳酸氢钠溶液制备碳酸镧的纯度高,理由是__________ (任写一条)。
②请写出用碳酸氢钠溶液制备碳酸镧的离子方程式_____________________________。
③所制碳酸镧需经洗涤,才能达到医用要求,请写出对碳酸镧沉淀洗涤的方法:
___________________________________________________。
(3)碳酸镧(式量为458)质量分数的测定:准确称取 10.0g 产品试样,溶于10.0mL稀盐酸中,加入10mL NH3-NH4Cl 缓冲溶液,加入 0.2g 紫脲酸铵混合指示剂,用 0.5 mol·L-1EDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y2-= LaY-+2H+),消耗 EDTA 溶液 40.00mL。则产品中碳酸镧的质量分数 w=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污
B. 将三氯化铁溶于盐酸中配制三氯化铁溶液
C. 加热氯化铁溶液颜色变深
D. 硫酸氢钠溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾是一种高效的多功能水处理剂,具有强氧化性。制备高铁酸钾方法很多。
(1)干法制备高铁酸钾。将Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物。此制备反应中,氧化剂与还原剂的物质的量之比为_____________________。
(2)湿法制备高铁酸钾。工业上常采用NaClO氧化法生产,原理如下:
a.3NaClO+2Fe(NO3)3+ 10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
b.Na2FeO4+2KOH =K2FeO4+2NaOH
主要的生产流程如图:
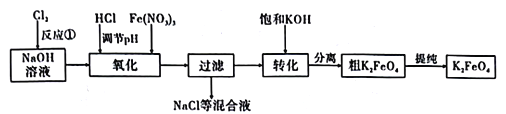
①流程图中“转化”是在某低温下进行的,说明此温度下的溶解度S(K2FeO4)_____S(Na2FeO4)(填“>”“<”或“=”)。
②湿法制备中,反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。如图,图甲为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图乙为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。工业生产中最佳温度为_________℃,此时Fe(NO3)3与NaClO 两种溶液最佳质量浓度之比为______________。

③若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:_____________________。若Fe( NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式为__________________________________。
(3)K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。
①在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用__________溶液(填序号)。
A.H2O B.CH3COOK、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
②K2FeO4在处理水的过程中所起的作用有_______________________。
(4)室温下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+转化为Fe(O H)3沉淀,从而除去Fe3+。该反应的平衡常数为_____________________。(已知常温下的溶度积常数:Ksp[Cu(OH)2]=2.0×10-20, Ksp[Fe(OH)3]=4.0×10-38)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com