
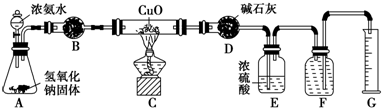
 氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:
氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:| V |
| Vm |
| ||
| m |
| n |
| ||
| ||
| aL |
| 22.4L/mol |
| a |
| 22.4 |
| ||
| a |
| 22.4 |
| 3a |
| 22.4 |
| bg |
| 18g/mol |
| b |
| 18 |
| b |
| 18 |
| b |
| 9 |
| a |
| 22.4 |
| b |
| 9 |
| 9a |
| 11.2b |
| 9a |
| 11.2b |


科目:高中化学 来源: 题型:
 的名称
的名称 与足量浓Br2水充分反应:
与足量浓Br2水充分反应:
查看答案和解析>>
科目:高中化学 来源: 题型:
 铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
铁及其化合物应用广泛,例如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:


 .请设计以
.请设计以 和
和 为原料合成化合物
为原料合成化合物 的实验方案.(用合成路线流程图表示为:A
的实验方案.(用合成路线流程图表示为:A| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体A为SO2和H2的混合物 |
| B、气体A中SO2和H2的体积比为4:1 |
| C、反应中共消耗锌97.5 g |
| D、反应中共转移电子1.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a(g) | 起始读数(mL) | b(mL) | c(mL) |
| 0.1970 | 0.00 | 31.30 | 42.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
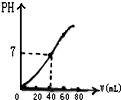 用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A、1.0mol?L-1、60mL |
| B、0.5mol?L-1、80mL |
| C、0.5mol?L-1、40mL |
| D、1.0mol?L-1、80mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com