
(8分)某小组对过氧化钠的性质和用途进行探究。
(1)观察其外观,可获知的物理性质是 。
(2)将CuSO4溶液加入盛有少量Na2O2固体的试管中,可以观察到的现象是 ,发生反应的化学方程式依次为 。
(3)Na2O2可用于潜水艇中作为氧气的来源,若消耗100g Na2O2,能生成标准状况下多少体积的O2?(写出计算过程)
(1)Na2O2在常温下为淡黄色固体(1分)
(2)有气泡产生,溶液中产生蓝色沉淀。(2分)
2Na2O2+2H2O=4NaOH+O2↑ 2NaOH+CuSO4=Cu(OH)2↓+Na2SO4 (各1分,共2分)
(3)设标准状况下产生氧气的体积为x
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2×78g 22.4L
100g x
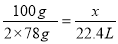
x =14.36 L (3分)
答:标准状况下产生氧气的体积为14.36 L。
【解析】
试题分析:(1)观察其外观,可获知的物理性质是颜色状态,则为:Na2O2在常温下为淡黄色固体;(2)将CuSO4溶液加入盛有少量Na2O2固体的试管中,Na2O2与水反应产生NaOH和氧气,NaOH与CuSO4反应产生Cu(OH)2沉淀和Na2SO4,现象为:有气泡产生,溶液中产生蓝色沉淀;发生反应的化学方程式依次为:2Na2O2+2H2O=4NaOH+O2↑,2NaOH+CuSO4=Cu(OH)2↓+Na2SO4;(3)Na2O2可用于潜水艇中作为氧气的来源,若消耗100g Na2O2,能生成标准状况下O2的体积可根据方程式计算如下:
设标准状况下产生氧气的体积为x
2Na2O2 + 2CO2 = 2Na2CO3 + O2
2×78g 22.4L
100g x
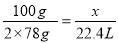
x =14.36 L (3分)
答:标准状况下产生氧气的体积为14.36 L。
考点:考查钠的化合物的性质。


科目:高中化学 来源:2014-2015江苏省高二第一学期化学试卷(解析版) 题型:填空题
(12分)某科研小组设计出利用工业废酸(稀H2SO4)来浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
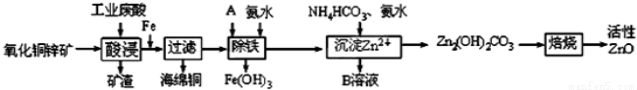
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 6.34 | 9.7 |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是 。(任写一点即可)
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:
Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。
(3)物质A最好使用下列物质中的 。
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在 范围之间。
(5)物质B可直接用作氮肥,则B的化学式是 。
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省浏阳市高二上学期理科化学试卷(解析版) 题型:选择题
在理论上不能用于设计原电池的化学反应是
A.NaCl(aq)+ AgNO3(aq)= AgCl(s)+ NaNO3(aq )△H<0
B.2CH3OH (l) +3O2 (g) = 2CO2 (g) + 4H2O (l)△H<0
C.2FeCl3(aq)+Fe(s) = 3FeCl3(aq) △H < 0
D.2H2 (g) + O2 (g) = 2H2O (l) △H < 0
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省怀化市小学课改高二上学期期末化学试卷(解析版) 题型:选择题
根据金属活动性顺序表,Ag不能发生2Ag+2HCl = 2AgCl+H2↑的反应。但选择恰当电极材料和电解液进行电解,这个反应就能变为现实。下列四组电极和电解液中,能实现该反应最为恰当的是
A | B | C | D | |
阳极 | 石墨棒 | Ag | Fe | Ag |
阴极 | 石墨棒 | 石墨棒 | Ag | Pt |
电解液 | CuCl2溶液 | 盐酸溶液 | H2SO4溶液 | H2O |
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省怀化市小学课改高二上学期期末化学试卷(解析版) 题型:选择题
已知25 ℃、101 kPa条件下:3O2(g)=2O3(g) ΔH=+284.2 kJ·mol-1下列说法正确的是
A.等质量的O2比O3能量低,由O2变O3为吸热反应
B.等质量的O2比O3能量高,由O2变O3为放热反应
C.O3比O2稳定,由O2变O3为吸热反应
D.O2比O3稳定,由O2变O3为放热反应
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末化学试卷(解析版) 题型:选择题
若NA表示阿伏加德罗常数,下列说法正确的是
A.22g CO2中含有NA个氧原子
B.通常状况下,11.2 L氮气中含有NA个氮原子
C.2mol铝与足量稀盐酸反应生成3NA个氢气分子
D.标准状况下,22.4 L H2O中含有NA个水分子
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省广州市高一上学期期末化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是
A.铝片与氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑
B.氧化亚铁粉末溶于盐酸中:Fe2O3+6H+=2Fe3++3H2O
C.向氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-
D.向氯化铝溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市黄浦区高三上学期期末调研测试化学试卷(解析版) 题型:填空题
(本题共13分)氨的催化氧化是工业制硝酸的重要反应,500°C,其反应方程式为:
4NH3(g) +5O2(g) 4NO(g)+6H2O(g)+Q,完成下列填空:
4NO(g)+6H2O(g)+Q,完成下列填空:
23.如果要提高上述反应的反应速率,可以采取的措施是
a.减压 b.增加NH3的浓度 c.升温 d.将水液化移走
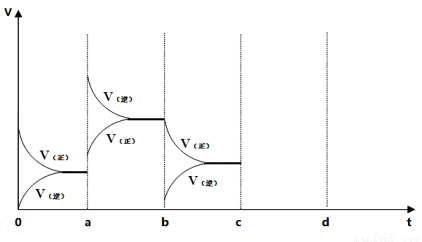
24.在500℃时,在2L密闭容器中加入10mol NH3、10mol O2,上述可逆反应达到平衡,过程如图所示,在a时刻改变反应条件,重新达到平衡,该改变的条件可能是 ,比较b时刻与c时刻反应氨的转化率大小(填“>”或“<”)b c。其它条件不变,c时刻加压后,若平衡正向移动,其原因可能是 ,若在d时刻重新达到平衡,请在图中画出c到d的相关变化图像。
25.工业上以氨和空气为原料生产硝酸,请画出硝酸工业的物质流程图。
26.氨中氮元素原子最外层电子排布的轨道表达式是 ,短周期元素原子所形成的与N3-电子排布相同的离子所对应的原子的半径从大到小的排列顺序为 。其中非金属元素形成的氢化物的稳定性由强到弱为的顺序为(用化学式表示) 。
27.已知NH3与N2H4都是氮的氢化物,N2H4的电子式是 。NH3与N2H4都具有还原性,可以与其它强氧化剂反应,例如在一定条件下,氨可以被双氧水氧化为游离态氮,写出该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com