
【题目】煤的气化主要生成CO、H2等,其中CO、H2是用途相当广泛的化工基础原料。但煤的气化获得的化工原料气中常含有少量羰基硫(COS),能引起催化剂中毒、大气污染等。
(1)COS的电子式为_____________________。
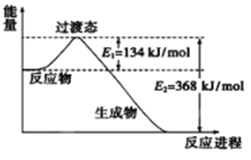
(2)下图是1molCO和lmolNO2反应生成两种气态氧化物过程屮能量变化示意图。已知14克CO参加反应时转移电子数为NA。写出该反应的热化学方程式_______________________。
(3)在某一恒温、恒容的密闭容器中发生以下反应:Ni(S)+4CO(g) ![]() Ni(CO)4(g)。下列说法正确的是__________。
Ni(CO)4(g)。下列说法正确的是__________。
A.该反应的反应热△H<0
B.增加Ni的量可提高CO的转化率,Ni的转化率降低
C.反应达到平衡后,充入CO再次达到平衡时,CO的浓度增大
D.当v正[Ni(CO)4]=4v逆(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衝状态
(4)工业上采用CO与H2反应合成甲醇,反应如下CO(g)+2H2(g)![]() CH3OH(g)。在T℃时,将2molCO和amolH2充入2L的恒容密闭容器中充分反应,l0min后反应达到平衡。已知v(CH3OH)=0.05molL-1min-1,且CO和H2的转化率相等。
CH3OH(g)。在T℃时,将2molCO和amolH2充入2L的恒容密闭容器中充分反应,l0min后反应达到平衡。已知v(CH3OH)=0.05molL-1min-1,且CO和H2的转化率相等。
①H2的转化率为_________________,反应未开始时的容器内气体压强P1与反应达平衡时压强P2的比值为__________________。
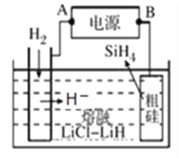
②以甲醇燃料电池为电源,熔融盐电解法制取硅烷原理如图。阳极的电极反应式为_______________。
(5)甲醇可制备二甲醚:2CH3OH(g)![]() CH3OCH3(g)+ H2O(g),K =1 (300℃测定)。
CH3OCH3(g)+ H2O(g),K =1 (300℃测定)。
①在300℃时,测得n(CH3OCH3)=2n(CH3OH),此时反应的v正__________v逆(填“〉”、“〈”或“=”〉,你的分析理由是___________________。
②二甲醚催化重整制氢的反应过程,主要包括以下几个反应(以下数据为25℃、1.01×l05Pa测定):
Ⅰ:CH3OCH3(g)+H2O(1)![]() 2CH3OH(1)△H>0
2CH3OH(1)△H>0
Ⅱ:CH3OH(1)+H2O(1)![]() CO2(g)+3H2(g)△H>0
CO2(g)+3H2(g)△H>0
Ⅲ:CO(g)+H2O(1)![]() CO2(g)+H2(g)△H<0
CO2(g)+H2(g)△H<0
Ⅳ:CH3OH(l)![]() CO(g)-2H2(g)△H>0
CO(g)-2H2(g)△H>0
工业生产中测得不同温度下各组分体积分数及二甲醚转化率的关系如下图所示,
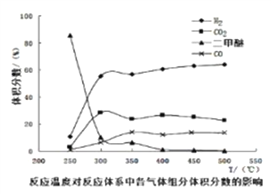

你认为反应控制的最佳温度应为__________。
A. 300350℃ B. 35040℃ C. 400450℃ D. 450500℃
【答案】 ![]() NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol AC 50% 3∶2 Si+4H+-4e-=SiH4 < Qc=
NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234kJ/mol AC 50% 3∶2 Si+4H+-4e-=SiH4 < Qc=![]() =4>1,此时反应向逆向进行,所以 v正逆 C
=4>1,此时反应向逆向进行,所以 v正逆 C
【解析】(1)COS与CO2是等电子体,结构相似,电子式为![]() ;1molCO和lmolNO2反应生成两种气态氧化物,CO2和NO,14克CO参加反应时转移电子数为NA。 NO2(g)+CO(g)=CO2(g)+NO(g) △H=(134-368)kJ/mol=-234kJ/mol;(3)A.升高温度,向逆向进行,该反应的反应热△H<0,故A正确;B.Ni是固体,增加Ni的量不能提高CO的转化率,故B错误;C.反应达到平衡后,充入CO再次达到平衡时,CO的转化率降低,CO的浓度增大,故C正确;D.当v正[Ni(CO)4]=1/4v逆(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衝状态,故D错误;故选AC。(4)①生的CH3OH为0.05molL-1min-1×10min×2L=1mol,反应的CO为1mol,CO和H2的转化率相,1mol/2mol×100%=50%,H2的转化率为50%;a=4mol,平衡时各物质的量为1molCO、2molH2,1molCH3OH,反应未开始时的容器内气体压强P1与反应达平衡时压强P2的比值为(2+4)/(1+2+1)=3:2;②以甲醇燃料电池为电源,熔融盐电解法制取硅烷,阳极硅失电子发生氧化反应,电极反应式为 Si+4H+-4e-=SiH4 ;(5)甲醇可制备二甲醚:2CH3OH(g)
;1molCO和lmolNO2反应生成两种气态氧化物,CO2和NO,14克CO参加反应时转移电子数为NA。 NO2(g)+CO(g)=CO2(g)+NO(g) △H=(134-368)kJ/mol=-234kJ/mol;(3)A.升高温度,向逆向进行,该反应的反应热△H<0,故A正确;B.Ni是固体,增加Ni的量不能提高CO的转化率,故B错误;C.反应达到平衡后,充入CO再次达到平衡时,CO的转化率降低,CO的浓度增大,故C正确;D.当v正[Ni(CO)4]=1/4v逆(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衝状态,故D错误;故选AC。(4)①生的CH3OH为0.05molL-1min-1×10min×2L=1mol,反应的CO为1mol,CO和H2的转化率相,1mol/2mol×100%=50%,H2的转化率为50%;a=4mol,平衡时各物质的量为1molCO、2molH2,1molCH3OH,反应未开始时的容器内气体压强P1与反应达平衡时压强P2的比值为(2+4)/(1+2+1)=3:2;②以甲醇燃料电池为电源,熔融盐电解法制取硅烷,阳极硅失电子发生氧化反应,电极反应式为 Si+4H+-4e-=SiH4 ;(5)甲醇可制备二甲醚:2CH3OH(g)![]() CH3OCH3(g)+ H2O(g),K =1 (300℃测定)。①在300℃时,测得n(CH3OCH3)=2n(CH3OH),此时反应的v正逆,理由是Qc=
CH3OCH3(g)+ H2O(g),K =1 (300℃测定)。①在300℃时,测得n(CH3OCH3)=2n(CH3OH),此时反应的v正逆,理由是Qc=![]() =4>1,此时反应向逆向进行,所以 v正逆;② 400450℃二甲醚的转化率较高,再升高温度,增大成本,转化率提高有限,温度太低,反应速率太慢。
=4>1,此时反应向逆向进行,所以 v正逆;② 400450℃二甲醚的转化率较高,再升高温度,增大成本,转化率提高有限,温度太低,反应速率太慢。


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】甲乙两种固体的溶解度曲线如右图所示。有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在,现将温度由80℃降到20℃。下列说法错误的是( )
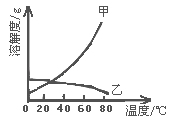
A. 杯中固体甲增多、固体乙减少
B. 杯中一定有固体甲而不一定有固体乙
C. 溶液中溶质甲减少、溶质乙增多
D. 甲和乙的两种溶液仍然一定是饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法不正确的是( )
A. 1mol醋酸的质量与NA个醋酸分子的质量相等
B. NA个氧分子和NA个氮分子的质量比等于8:7
C. 28g氮气所含的原子数目为NA
D. 在标准状况下,0.5NA个氯气分子所占体积约是11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业烧碱中常含有少量NaCl。为测定烧碱中NaOH的质量分数,称取1.6g样品与19.00mL、2.0molL—1盐酸恰好反应。
(1)求所消耗盐酸中HCl的物质的量_____________
(2)求工业烧碱中NaOH的纯度_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是 ( )
A.有单质生成的反应一定是氧化还原反应
B.焰色反应是元素表现出来的化学性质
C.由两种元素组成,原子个数比为1:1的物质一定是纯净物
D.能与酸反应产物中有盐和水的氧化物不一定是碱性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气凝胶是一种世界上最轻的固体,世被称为“固态烟”,非常坚固耐用,它可以承受相当于自身重量几千倍的压力,最高能承受1400摄氏度的高温,绝热性能十分优越,其主要成分是二氧化硅等。下列说法正确的是( )
A. 该材料具有良好的导电性
B. 二氧化硅可用于制作光导纤维
C. 二氧化硅耐所有的酸和碱
D. 水泥的主要成分是二氧化硅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.10 | 0.10 | 0.09 |
② | 800 | 0.20 | 0.20 | 0.10 |
③ | 800 | 0.20 | 0. 30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法错误的是
A.实验①中,若5 min时测得n(M) =0.05 mol,则0至5 min时间内,用N表示的平均反应速率v(N) =
0.01 mol/( L·min)
B.实验②中,该反应的平衡常数K=1.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.06
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取0.2mol/LHX溶液与0.2mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8(25℃),则下列说法(或关系式)正确的是( )
A. c(Na+)﹣c(X-)=9.9×10-7mol/L
B. c(Na+)= c(X-)+c(HX)= 0.2mol/L
C. 混合溶液中由水电离出的c(OH-)= 1×10-8mol/L
D. c(OH-)﹣c(HX)= c(H+)=1×l0-6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)凯氏定氨法是测定蛋白质中氮含量的经典方法,其原理是用浓硫酸在催化剂存在下将样品中有机氮转化成铵盐,利用如图所示装置处理铵盐,然后通过滴定测量。已知:
NH3+H3BO3=NH3·H3BO3;
NH3·H3BO3+HCl= NH4Cl+ H3BO3。
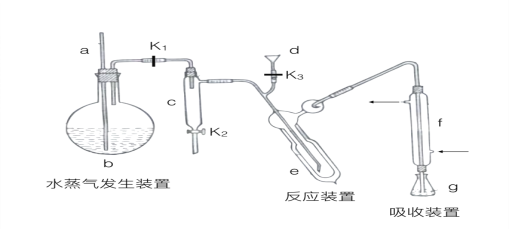
回答下列问题:
(1)a的作用是_______________。
(2)b中放入少量碎瓷片的目的是____________。f的名称是__________________。
(3)清洗仪器:g中加蒸馏水:打开k1,关闭k2、k3,加热b,蒸气充满管路:停止加热,关闭k1,g中蒸馏水倒吸进入c,原因是____________;打开k2放掉水,重复操作2~3次。
(4)仪器清洗后,g中加入硼酸(H3BO3)和指示剂,铵盐试样由d注入e,随后注入氢氧化钠溶液,用蒸馏水冲洗d,关闭k3,d中保留少量水,打开k1,加热b,使水蒸气进入e。
①d中保留少量水的目的是___________________。
②e中主要反应的离子方程式为________________,e采用中空双层玻璃瓶的作用是________。
(5)取某甘氨酸(C2H5NO2)样品m 克进行测定,滴定g中吸收液时消耗浓度为cmol·L-1的盐酸V mL,则样品中氮的质量分数为_________%,样品的纯度≤_______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com