
| c(CH3COOH)?c(OH-) |
| c(CH3COO-) |
| Kw |
| Ka |
| c(CH3COOH)?c(OH-) |
| c(CH3COO-) |
| Kw |
| Ka |
| 10-14 |
| 1.8��10-5 |
| ||
| 0.5 |
| ||
| 1 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��5 | B��4 | C��3 | D��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
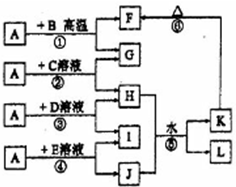 ��ͼ��ʾ��A��G��I��Ϊ���ʣ�����A��GΪ�����Ҷ�����������絼�߲��ϣ�BΪ��ɫ��ĩ��L��������Ԫ����ɵ��Σ����Ǽ�ͥ�����ر���Ʒ����ش�
��ͼ��ʾ��A��G��I��Ϊ���ʣ�����A��GΪ�����Ҷ�����������絼�߲��ϣ�BΪ��ɫ��ĩ��L��������Ԫ����ɵ��Σ����Ǽ�ͥ�����ر���Ʒ����ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��16gO2�к��е�����������Ϊ0.5NA |
| B�����³�ѹ�£�1molNe���е�ԭ����ΪNA |
| C��1.6gCH4�к��еļ��������Ϊ0.1NA |
| D��1mol/LNaCl��Һ�к��е���������ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ˮ�����ӻ�Kw���¶ȡ�����ᣨ�Ũ�ȵĸı���ı� |
| B�����Է����еĻ�ѧ��Ӧ��һ���ǡ�H��0����S��0 |
| C����������ʵ�������ӵ����������ӽ�ϳɷ��ӵ��������ʱ�ﵽ����ƽ��״̬ |
| D��Ksp���������ܵ���ʵ����ʺ��¶��йأ�������Һ�е�����Ũ���й� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��25�棬pH=2��HCl��Һ�к���H+����ĿΪ0.01NA |
| B��1mol Na2O2�����к��е�������������Ϊ4 NA |
| C��1mol̼ϩ����CH2���к��еĵ�����8NA |
| D��5.6g���������ᷴӦʧȥ�ĵ�����һ��Ϊ0.3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ռ�ʱ������ʹ����ͨʯӢ������SiO2+2NaOH�TNa2SiO3+H2O | ||||
| B���ں����ҵĽ���Һ������I-���еμ�H2O2�õ�I2��2I-+H2O2+2H+=I2+O2��+2H2O | ||||
C�����ȵ���˿��ˮ�Ӵ��������γɺ�ɫ�����㣺3Fe+4H2O��g��
| ||||
| D����84����Һ������Ч�ɷ�NaClO���͡�����顰����Ҫ�ɷ����ᣩ���ʹ�÷ų�������ClO-+Cl-+2H+=Cl2��+H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com