
| A、氧 | B、氯 | C、氟 | D、硫 |
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
| A、铁与足量稀硝酸反应,1 mol Fe失去电子数为3NA |
| B、常温常压下,22.4L 乙烯中含极性共价键数目为5NA |
| C、1 mol Cu与足量浓硫酸反应产生2NA个SO2分子 |
| D、1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,50g SO2和CO2的混合气体中可能含有2NA个氧原子 |
| B、1mol Cl2与足量的铁反应,转移的电子数为3NA |
| C、1L0.1mol?L-1氨水含有0.1lNA个OH- |
| D、1mol甲醇中含有C-H键的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分别测定SO2、CO2饱和溶液的PH,可比较H2SO3、H2CO3二酸的强弱 |
| B、先滴入少量氯水,后滴入KSCN试液,可确定溶液中是否含Fe2+ |
| C、25℃若测知氨水与NH4Cl混合溶液的pH>7,可确定溶液中c(NH4+)>c(Cl-) |
| D、固体NH2COONH4(s)在密闭容器中存在:NH2COONH4(s)?2NH3(g)+CO2(g)△S>0,由此可确定反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
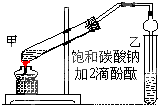 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 14.5 | 29.6 | 47.4 | 77.5 | 97.9 | 551.9 | 666.8 |
| A、IA | B、ⅢA | C、ⅤA | D、ⅦA |
查看答案和解析>>
科目:高中化学 来源: 题型:
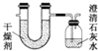 已知某种燃料含有碳、氢二种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
已知某种燃料含有碳、氢二种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101.1g | 102.9g |
| (澄清石灰水+广口瓶)的质量 | 312.0g | 314.2g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com