


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| Q | Q的气态氢化物是一种10电子微粒,呈现碱性 |
| R | R是地壳中含量最丰富的元素 |
| X | X与Y在同一周期,X是这一周期中原子半径最大的元素 |
| Y | Y的次外层电子数是最外层电子数的两倍 |
| Z | Z是一种副族的金属元素,原子序数为26 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
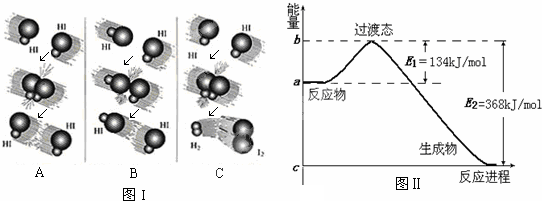
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe、Cu的单质长期旋转都易生锈,铁锈、铜锈成分都是氧化物 |
| B、Fe、Cu的单质都能在氯气中燃烧,产物中Fe、Cu的化合价不同 |
| C、向FeC13溶液中加入过量铜粉,充分反应后,未有铁单质生成 |
| D、工业由矿石冶炼Fe、Cu单质用还原剂还原法,铜的精炼用电解法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com