

分析 (1)①由方程式可知,生成C与消耗的A、B物质的量均相等,根据v=$\frac{△c}{△t}$计算v(B),计算平衡时各组分浓度,代入平衡常数K=$\frac{c(C)}{c(A)×c(B)}$计算;
②恒温恒容下,开始加入1molA气体和1molB气体与开始加入1molC气体是完全等效平衡,平衡时相同组分的物质的量相同,设加入1molA气体和1molB气体达到平衡时,放出的热量为Q3,则Q2+Q3=a;
保持容器温度和容积不变,加入2molA气体和2molB气体与加入1molA气体和1molB气体相比,相当于增大一倍的压强,增大压强平衡正向移动,所以放出的热量Q1>2Q3;
(2)①tmin时刻瞬间各组分的物质的量未变,而后反应速率加快,可能是反应受热或使用了催化剂;
②3tmin时改变条件后,甲醇的物质的量增大、氢气物质的量减小,改变条件平衡向正反应移动,CO的物质的量减小,至4min时氢气物质的量减小0.2mol,CO应减小0.1mol,而4tmin时CO的物质的量为0.5mol,CO物质的量增大0.1mol,则3min时应是加入CO,设加入的CO为xmol,则:x+0.4-0.1=0.5,故x=0.2mol;
(3)①若二者恰好反应得到CH3COONa溶液,溶液中CH3COO-水解呈碱性,反应后溶液pH=7,溶液就呈中性,故反应时醋酸应过量;
溶液pH=7,则c(H+)=c(OH-),再结合电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)判断;
②根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒:c(Na+)=2[c(CH3COO-)+c(CH3COOH)],联立计算;
(4)某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂作用下可制得甲烷,己知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol
根据盖斯定律,②×4-①可得CO2(g)+4H2(g)=CH4(g)+2H2O(l).
解答 解:(1)①容积为1L的恒温恒容密闭容器,20s内生成1molC气体,根据A(g)+B(g)?C(g),可知BA、B气体均减少1mol,浓度变化减少均为0.5mol/L,则v(B)=$\frac{0.5mol/L}{20s}$=0.025mol/(L•s);
平衡时A、B浓度均为1mol/L-0.5mol/L=0.5mol/L,C为0.5mol/L,则平衡常数K=$\frac{c(C)}{c(A)×c(B)}$=$\frac{0.5}{0.5×0.5}$=2,
故答案为:0.025mol/(L•s);2;
②恒温恒容下,开始加入1molA气体和1molB气体与开始加入1molC气体是完全等效平衡,平衡时相同组分的物质的量相同,设加入1molA气体和1molB气体达到平衡时,放出的热量为Q3,则Q+Q3=a;
保持容器温度和容积不变,加入2molA气体和2molB气体与加入1molA气体和1molB气体相比,相当于增大一倍的压强,增大压强平衡正向移动,所以放出的热量Q1>2Q3,联立可得:Q1+2Q2>2a,
故选:(C);
(2)①tmin时刻瞬间各组分的物质的量未变,而后反应速率加快,可能是反应受热或使用了催化剂,
故答案为:反应受热或使用了催化剂;
②3tmin时改变条件后,甲醇的物质的量增大、氢气物质的量减小,改变条件平衡向正反应移动,CO的物质的量减小,至4min时氢气物质的量减小0.2mol,CO应减小0.1mol,而4tmin时CO的物质的量为0.5mol,CO物质的量增大0.1mol,则3min时应是加入CO,设加入的CO为xmol,则:x+0.4-0.1=0.5,故x=0.2mol,故CO的变化曲线为: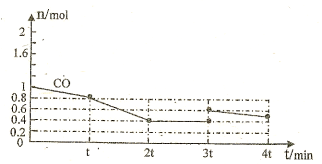
故答案为: ;
;
(3)①若二者恰好反应得到CH3COONa溶液,溶液中CH3COO-水解呈碱性,反应后溶液pH=7,溶液就呈中性,故反应时醋酸应过量,则VmL×0.1000mol•L-1<20.00mL×0.1000mol•L-1,故V<20;
溶液pH=7,则c(H+)=c(OH-),由电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),水的电离是微弱的,所以c(Na+)=c(CH3COO-)>c(H+)=c(OH-),
故答案为:<;c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
②根据电荷守恒:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒:c(Na+)=2[c(CH3COO-)+c(CH3COOH)],则c(OH-)-c(H+)-c(CH3COOH)=c(CH3COO-)+c(CH3COOH),反应后溶液的体积变为60mL,则c(CH3COO-)+c(CH3COOH)═$\frac{0.1mol/L×0.02mL}{0.06mL}$=0.033mol/L,
故答案为:0.033;
(4)某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂作用下可制得甲烷,己知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8KJ/mol
根据盖斯定律,②×4-①可得:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(l)△H=-252.9kJ/mol.
点评 本题考查化学平衡计算与影响因素、离子浓度比较、热化学方程式书写等,(1)注意构建等效平衡建立途径判断反应热,(2)中作图为易错点,学生容易考查CO变化趋势,而忽略定量问题,难度中等.


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 66 | 70 | 143 | 160 |
| 主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
| A. | W和Y形成的化合物中含有离子键和非极性键 | |
| B. | 一定条件下,X单质可以将Y单质从其氢化物中置换出来 | |
| C. | Z的最高价氧化物能溶于氨水 | |
| D. | Y的简单气态氢化物的沸点高于 X的简单气态氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②K值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.
“低碳生活”既是时尚,也是环保要求.目前碳及其化合物的综合利用已成为科学家研究的重要课题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3)(4) | B. | (1)(2) | C. | (3)(4) | D. | (2)(4) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com