
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物Al2H6的球棍模型如图所示,它的熔点为150℃,燃烧热极高.下列说法肯定错误的是( )
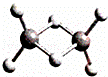
|
| A. | Al2H6在固态时所形成的晶体是分子晶体 |
|
| B. | Al2H6在空气中完全燃烧,产物为氧化铝和水 |
|
| C. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 |
|
| D. | 氢铝化合物中可能存在组成为AlnH2n+2的物质(n为正整数) |
| 镁、铝的重要化合物;球棍模型与比例模型. | |
| 专题: | 元素及其化合物. |
| 分析: | 根据分子晶体的熔点较低,结合题中的给出Al2H6的熔点为150℃,因此推出其为分子晶体,同时题意中又告诉Al2H6的燃烧热极高,推出它能燃烧,根据原子守恒推出燃烧产物;氢气是一种气体,储存和运输都不方便,将其转化氢铝化合物,便于储存和运输;结合化合物中正负化合价的代数和为0等知识点解决. |
| 解答: | 解:A•分子晶体的熔点较低,通过题中给出的Al2H6的熔点为150℃,推出Al2H6为分子晶体,故A正确; B•根据题中信息Al2H6的燃烧热极高,判断Al2H6能燃烧,根据原子守恒,Al2H6的组成元素只有Al、H两种元素,又由于是在氧气中燃烧,推出燃烧产物为氧化铝和水,故B正确; C•根据氢铝化合物组成元素为Al和H两种元素,而Al和H2都是很好的燃料,但氢气的在储存盒运输中是极不方便,将其转化成氢铝化合物后,就解决这一矛盾,同时氢铝化合物的燃烧热极高因此可以作为未来的储氢材料和火箭燃料.故C正确; D•根据化合物中正负化合价的代数和为0,在AlnH2n+2组成中,有3n+[﹣(2n+2)]=0,则有3n=2n+2,n=2,推出化学式为:Al2H6符合要求,但这仅是一种情况,当n=1时,得出化学式为:AlH4不符合要求,所以AlnH2n+2不具有普遍性,故D错误. 故选:D. |
| 点评: | 本题考查了元素化合物的性质在实际中的应用,属于知识应用的问题,解决这类问题,需要将知识点与题中的信息有机的结合起来,解决时需分析清楚题意,要细心认真. |


科目:高中化学 来源: 题型:
鼠尾草酚可用于防治骨质疏松,鼠尾 草酸可两步
草酸可两步
转化得到鼠尾草酚,下列说法正确的是

A.X、Y、Z互为同分异构体
B.X、Z均能与FeCl3溶液发生显色反应
C.X、Y、Z分子中均含有2个手性碳原子
D.1molX与NaOH溶液反应最多消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
等物质的量的Na2CO3和NaHCO3分别与足量的同浓度盐酸溶液充分反应,其中
A.Na2CO3 放出的CO2 多 B.NaHCO3 放出的CO2 多
C.Na2CO3 放出CO2 的速度快 D.NaHCO3放出CO2 的速度快
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在生产和日常生活中有着重要的应用.下列叙述中错误的有( )
①汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
②人体中极少量的NO会促进血管扩张,防止血管栓塞
③工业上,焦炭在高温下还原二氧化硅得到粗硅,说明碳的还原性比硅强
④干冰或溴化银可用于人工降雨
⑤氟利昂(CCl2F2)因破坏大气臭氧层,会导致“温室效应”
⑥漂白粉既可作漂白棉、麻、纸张的漂白剂,又可用作游泳池及环境的消毒剂.
A. 1个 B. 2个 C. 3个 D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
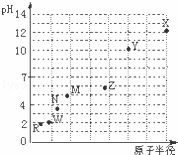
第三周期元素,浓度均为0.01mol/L的最高价氧化物对应水化物的pH与原子半径的关系如图所示.则下列说法正确的是( )
|
| A. | 气态氢化物的稳定性:M>N |
|
| B. | Z的最高价氧化物对应的水化物能溶于稀氨水 |
|
| C. | X和W形成的常见化合物阴阳离子个数比为1:2 |
|
| D. | Z和R组成的化合物是弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
|
| A. | 在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I﹣、Br﹣、Fe2+ |
|
| B. | 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+ |
|
| C. | 在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3 |
|
| D. | 在含等物质的量的AlO2﹣、OH﹣、CO32﹣溶液中,逐滴加入盐酸:AlO2﹣、Al(OH)3、OH﹣、CO32﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式 .
(2)下列三种情况下,离子方程式与(1)相同的是 (填序号).
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO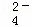 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用图1中的 曲线表示(填序号).
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图2所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应.在此实验过程中,小球将 .

查看答案和解析>>
科目:高中化学 来源: 题型:
某学习小组做以下实验:在溴水中加入足量乙醛溶液,充分反应,溴水褪色。为探究褪色的原因,他们提出了如下三种猜想:
①溴水中的Br2可能与乙醛发生取代反应
②乙醛分子中含有不饱和键,溴水可能与乙醛发生加成反应
③乙醛具有还原性,溴水可能将乙醛氧化为乙酸,Br2转化为HBr
为探究哪一种猜想正确,一研究小组提出了如下两种方案:
方案(一):检验褪色后溶液的酸碱性,确定其发生哪类反应
方案(二):测定反应前溴水中Br2的物质的量和反应后 Br-的物质的量确定其发生哪类反应
(1)方案(一)是 否可行?______ (填“可行”或“
否可行?______ (填“可行”或“ 不可行”) ;理由是:
不可行”) ;理由是: 
(2)假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)= mol, 则说明溴水与乙醛发生了取代反应
若测得反应后n(Br-)= mol,则说明溴水与 乙醛发生了加成反应
乙醛发生了加成反应
 若测得反应后n(Br-)= mol,则说明溴水将乙醛氧化为乙酸
若测得反应后n(Br-)= mol,则说明溴水将乙醛氧化为乙酸
(3)向含Br2 0.005mol的溴水中加入足量乙醛使其褪色,然后加过量的AgNO3溶液,过滤、洗涤、干燥、称量,得到固体1.88克。已知CH3COOAg易溶于水,通过计算,判断溴水与乙 醛发生的反应为 (填猜想序号),溴水与乙醛反应的化学方程式为
醛发生的反应为 (填猜想序号),溴水与乙醛反应的化学方程式为
(4 ) 已知柠檬醛的结构简式为
) 已知柠檬醛的结构简式为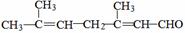 ,若要检验出其中的碳碳双键,其方法是 。
,若要检验出其中的碳碳双键,其方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列试验中,所选装置不合理的是 ( )
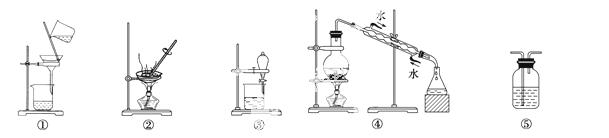
A.分离Na2CO3溶液和CH3COOC2H5,选④
B.用CCl4提取碘水中的碘,选③
C.用FeCl2溶液吸收Cl2选⑤
D.粗盐提纯,选①和②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com