已知A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大.A、C同主族,可形成离子化合物CA;B、D同主族,可形成DB2、DB3两种分子.请回答下列问题:
(1)元素E在元素周期表中的位置是______,A、B、C、D、E五种元素原子半径由小到大的顺序为______(用元素符号书写).
(2)A、B两种元素能形成两种常温下呈液态的化合物M、N,具有强氧化性的化合物M的电子式可表示为______;化合物N在同主族元素形成有具有相同结构的物质中,具有较高的沸点,其原因是______.
(3)在上述元素最高价氧化物对应的水化物中酸性最强的是______(写化学式,下同),非金属气态氢化物还原性最强的是______.
(4)A、B、C、D中的三种或四种元素能形成多种离子化合物,其中水溶液呈酸性的有______(写出所有化合物,用化学式表示,下同),能与稀盐酸发生氧化还原反应的有______.
【答案】
分析:A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大,所以A是H元素;A、C同主族,可形成离子化合物CA,且C原子序数B原子序数,所以C是Na元素;B、D同主族,可形成DB
2、DB
3两种分子,所以B是O元素,D是S元素,E是短周期主族元素,所以E是Cl元素.
解答:解:A、B、C、D、E五种主族元素分属三个短周期,且原子序数依次增大,所以A是H元素;A、C同主族,可形成离子化合物CA,且C原子序数B原子序数,所以C是Na元素;B、D同主族,可形成DB
2、DB
3两种分子,所以B是O元素,D是S元素,E是短周期主族元素,所以E是Cl元素.
(1)通过以上分析知,E是Cl元素,属于第三周期ⅦA族; 电子层数越多,原子半径越大,同一周期中,元素的原子半径随着原子序数的增大而减小,所以原子半径从小到达顺序为:H<O<Cl<S<Na.
故答案为:第三周期ⅦA族; H<O<Cl<S<Na.
(2)A、B两种元素能形成两种常温下呈液态的化合物有水和双氧水,双氧水具有强氧化性,所以具有强氧化性的化合物M是双氧水,双氧水的电子式可表示为

;化合物N是水,在同主族元素形成有具有相同结构的物质中,水分子间形成氢键导致水具有较高的沸点.
故答案为:

;水分子间存在氢键.
(3)非金属元素的非金属性越强,其相应的最高价含氧酸的酸性越强,这几种元素非金属性最强的是Cl元素,所以其最高价含氧酸的酸性最强的是高氯酸HClO
4;还原性最强的气态氢化物是硫化物 H
2S.
故答案为:HClO
4; H
2S.
(4)A、B、C、D中的三种或四种元素能形成多种离子化合物,其中水溶液呈酸性的有NaHSO
4、NaHSO
3;能和盐酸发生氧化还原反应的是 Na
2S
2O
3.
故答案为:NaHSO
4、NaHSO
3; Na
2S
2O
3.
点评:本题以元素推断为载体考查了元素化合物的性质,能正确判断元素是解本题的关键,明确硫代硫酸钠中硫元素的化合价有-2价和+4价,导致硫代硫酸钠和盐酸发生氧化还原反应.

 ;化合物N是水,在同主族元素形成有具有相同结构的物质中,水分子间形成氢键导致水具有较高的沸点.
;化合物N是水,在同主族元素形成有具有相同结构的物质中,水分子间形成氢键导致水具有较高的沸点. ;水分子间存在氢键.
;水分子间存在氢键.



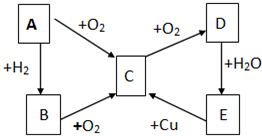 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: