
【题目】下面有关丙烷、丙烯、丙炔说法中正确的有
A.丙烷、丙烯、丙炔的结构式分别为
B.相同物质的量的三种物质完全燃烧,生成的气体在标准状态下,体积比3:2:1
C.丙烷、丙烯、丙炔三种物质的熔沸点逐渐升高,相对条件下密度逐渐增大
D.丙烷的碳原子空间结构是锯齿型的,不是简单的线性排列
科目:高中化学 来源: 题型:
【题目】利用如图所示装置可以模拟铁的电化学防护。下列说法不正确的是 ( )

A.若X为碳棒,开关K置于N处,为外加电源的阴极保护法,可减缓铁的腐蚀
B.若X为碳棒,开关K置于N处,X极发生氧化反应
C.若X为锌棒,开关K置于M处,为牺牲阳极的阴极保护法,可减缓铁的腐蚀
D.若X为锌棒,开关K置于M处,铁极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为五种气态烃,其中A、B、C都能使酸性高锰酸钾溶液褪色;1 mol C能与2 mol Br2完全加成,生成物分子中每个碳原子上有一个溴原子;A与C具有相同的通式;A与H2加成可得B,B与相同条件下N2的密度相同。D是最简单的有机物,E是D的同系物,完全燃烧相同物质的量的B、E生成CO2的量相同。
(1)试确定A、B、C、D、E的结构简式:
A_____________、B_____________、C_____________、D_____________、E_____________。
(2)等质量的A、B、C、D、E完全燃烧,耗氧量最多的是__________ (填字母序号,下同),生成二氧化碳最多的是__________。
(3)等物质的量的A、B、C、D、E完全燃烧,耗氧量最多的是__________ (填字母序号,下同),生成水最少的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
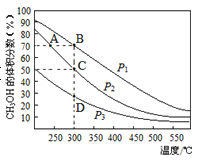
A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z位于不同短周期,原子序数依次增大。X、Z同主族,二者的原子序数之和是Y原子序数的两倍,主族元素W的原子最外层电子数比电子层数多4。下列说法不正确的是( )
A.简单离子半径:W>Z>X
B.X、Y、Z都能与W组成离子化合物
C.X、Y组成的化合物可与W单质反应
D.Q是Z、W组成的化合物,1 molQ中约含有6.02×1023个阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】课本里介绍的合成氨技术叫哈伯法,是德国诺贝尔化学奖获得者哈伯发明的。其合成原理为:N2(g)+3H2(g) ![]() 2NH3(g) △H<0,△S<0。
2NH3(g) △H<0,△S<0。
(1)下列关于工业合成氨的说法正确的是__________。
A.因为△H<0,所以该反应一定能自发进行
B.因为△S<0,所以该反应一定不能自发进行
C.在高温下进行是为了提高反应物的转化率
D.使用催化剂不仅可以加快反应速率还可以降低反应所需的温度
(2)一定温度下,在密闭容器中充入1molN2和3molH2并发生反应,若容器容积恒定,达到平衡时,气体的压强为原来的![]() ,则N2的转化率为______________。
,则N2的转化率为______________。
(3)工业上合成氨的部分工艺流程如下:
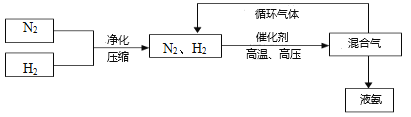
请用平衡移动原理来解释在流程中及时分离出氨气的原因_____________________________。
(4)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对工业合成氨反应的影响。实验结果如图所示(图中T表示温度,n表示H2物质的量)。

①图象中T2和T1的关系是:T2_______T1(填“>”“<”或“=”)
②a、b、c、d四点所处的平衡状态中,反应物N2的转化率最高的是___________(填字母)。
(5)恒温下,往一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下该反应的化学平衡常数K=_______________。
(6)氨氧化法是工业生产中制取硝酸的主要途径。
已知:N2(g)+3H2(g) ![]() 2NH3(g) △H= -92 kJ·mol-1
2NH3(g) △H= -92 kJ·mol-1
N2(g)+O2(g) ![]() 2NO(g) △H= +181 kJ·mol-1
2NO(g) △H= +181 kJ·mol-1
2H2(g)+O2 (g)![]() 2H2O(g) △H= -484 kJ·mol-1
2H2O(g) △H= -484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细![]() 氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为
氧化铝,既降低环境污染又可提高铝资源的利用率.已知铝灰的主要成分为![]() 含少量杂质
含少量杂质![]() 、FeO、
、FeO、![]() ,其制备实验流程如图1:
,其制备实验流程如图1:
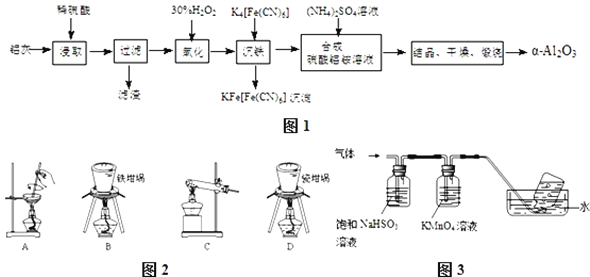
![]() 铝灰中氧化铝与硫酸反应的化学方程式为 ______ .
铝灰中氧化铝与硫酸反应的化学方程式为 ______ .
![]() 用图2中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 ______
用图2中“滤渣”和NaOH焙烧制备硅酸钠,可采用的装置为 ______ ![]() 填选项编号
填选项编号![]() .
.
![]() 在实验流程中,加
在实验流程中,加![]() 的
的![]() 溶液发生的离子反应方程式为 ______ .
溶液发生的离子反应方程式为 ______ .
![]() 验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 ______ .
验证“沉铁”后,溶液中是否还含有铁离子的操作方法为 ______ .
![]() 若用调节pH溶液“沉铁”,则得到
若用调节pH溶液“沉铁”,则得到![]() ,已知:
,已知:![]() 时,
时,![]() ,则该温度下反应
,则该温度下反应![]() 的平衡常数为 ______ .
的平衡常数为 ______ .
![]() 煅烧硫酸铝铵晶体,发生的主要反应为:
煅烧硫酸铝铵晶体,发生的主要反应为:![]()
![]()
![]() ,将产生的气体通过图3所示的装置.
,将产生的气体通过图3所示的装置.
①集气瓶中收集到的气体是 ______ ![]() 填化学式
填化学式![]() .
.
②![]() 溶液褪色,发生的离子反应方程式为 ______ .
溶液褪色,发生的离子反应方程式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。
查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+=Cu+Cu2++H2O
探究一:用如图所示装置进行实验,回答下列问题:

(1)仪器组装完成后,夹好止水夹,_____,则说明装置A的气密性良好.
(2)装置A是氢气的发生装置,可以选用的药品是________(填选项)
A.稀硫酸和锌片B.稀硝酸和铁片 C.氢氧化钠溶液和铝片D.浓硫酸和镁片
(3)从下列实验步骤中,选择正确的操作顺序:①________③(填序号).
①打开止水夹②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹
④点燃C处的酒精喷灯 ⑤收集氢气并验纯⑥通入气体一段时间,排尽装置内的空气
探究二:
(4)甲同学取少量样品于试管中,加入适量的稀硫酸,若无红色物质生成,则说明样品中不含Cu2O;乙同学认为观点不正确,其原因是_____________;丙同学另取少量样品于试管中,加入适量的浓硝酸,产生红棕色的气体.证明样品中一定含有________,其反应的离子方程式为_____;丁同学预设计实验证明另一种物质是否存在,其方案为__________。
(5)取一定量样品于烧杯中,加入足量的稀硫酸,若反应后经过滤得到固体3.2g,滤液中Fe2+有1.0mol,则样品中n(Cu2O)=_________mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是
A. 油脂在空气中完全燃烧转化为水和二氧化碳
B. 蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C. 在水溶液里,乙酸分子中的—CH3可以电离出H+
D. 在浓硫酸存在下,苯与浓硫酸共热生成硝基苯的反应属于取代反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com