
| 选项 | 物质(括号中为杂质) | 除杂试剂 | 操作 |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| B | 苯(苯酚) | 溴水 | 分液 |
| C | Fe2O3(Al2O3) | 氨水 | 过滤 |
| D | Cl2(HCl) | 饱和NaHCO3溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应;
B.三溴苯酚与苯互溶;
C.二者都不与氨水反应;
D.二者都与饱和碳酸氢钠溶液反应.
解答 解:A.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应,可用分液的方法分离,故A正确;
B.苯酚与溴反应生成三溴苯酚,三溴苯酚与苯互溶,不能得到纯净的苯,应用氢氧化钠溶液除杂,故B错误;
C.二者都不与氨水反应,氧化铝可与氢氧化钠溶液反应,应用氢氧化钠溶液,故C错误;
D.氯水溶液呈酸性,二者都与饱和碳酸氢钠溶液反应,应用饱和食盐水除杂,故D错误.
故选A.
点评 本题考查混合物分离、提纯方法的选择和应用,为高频考点,把握物质的性质及分离、提纯方法为解答的关键,侧重除杂的考查,注意除杂的原则,题目难度不大.


科目:高中化学 来源: 题型:解答题
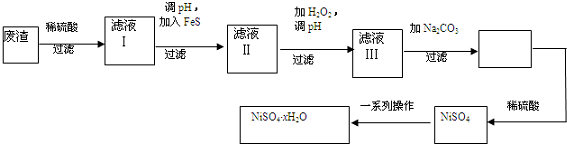
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热的反应一定是吸热反应 | |
| B. | 放热反应在常温下一定很容易发生 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 伴随能量变化的物质变化都是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属原子失去电子越多,还原性越强 | |
| B. | 盐酸酸化的高锰酸钾溶液氧化性更强 | |
| C. | 工业上镁铝单质都是电解对应熔融的氯化物得到的 | |
| D. | 强氧化剂与强还原剂不一定能发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大量燃烧化石燃料是造成雾霾天气的原因之一 | |
| B. | 燃料脱硫和减少汽车尾气排放都能减少酸雨的产生 | |
| C. | 从海水中提取物质都必须通过化学反应才能实现 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应:Na2O2+H2O=2Na++2OH-+O2↑ | |
| B. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 硫酸亚铁溶液中加入酸化的双氧水:2Fe2++2H++H2O2=2Fe3++2H2O | |
| D. | Ba(OH)2溶液中加入过量的NaHSO4溶液:Ba2++SO42-+OH-+H+=BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液AG=0 | |
| B. | 酸性溶液AG>0 | |
| C. | 常温下0.1mol/L的氢氧化钠溶液的AG=12 | |
| D. | 常温下0.1mol/L的醋酸溶液的AG=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g O2所含的原子数目为2NA | |
| B. | 11.2L H2O含有的原子数目为1.5NA | |
| C. | 1mol的Cl-含NA个电子 | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为是0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com