
| A | B | C | D | |
图示 |
 |
 |
 |
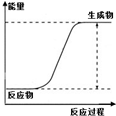 |
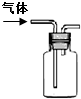
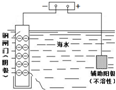
| 说明 | 该仪器用于配制一定质量分数的溶液 | 该装置可以收集二氧化氮 | 该装置可保护钢闸门不被腐蚀 | 该化学反应为吸热反应 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 检验方法 | 结论 |
| A | 向一种未知溶液中加入BaCl2溶液,有白色沉淀生成 | 未知溶液中一定含有SO42- |
| B | 向一种未知溶液中滴加KSCN溶液,溶液变为红色 | 未知溶液中一定含有Fe3+ |
| C | 向一种未知溶液中先加入盐酸酸化,再滴加AgNO3溶液,有白色沉淀生成 | 未知溶液中不一定含有Cl- |
| D | 向一种未知溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色气体 | 不能确定未知溶液中一定含有CO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=7的CH3COOH与CH3COONa的混合液中离子浓度的大小顺序为:c(Na+)>c(CH3COO-)>c(H+)=c(OH-) |
| B、25℃时,0.1mol/L NaHA溶液pH=3,该溶液中某些微粒的浓度大小顺序为:c(HA-)>c(H+)>c(H2A)>c(A2-) |
| C、25℃时,若10mL pH=a的盐酸与100mL pH=b 的Ba(OH)2溶液混合后恰好中和,则a+b=13 |
| D、25℃时,Ka(HF)=3.6×10-4,Ka(CH3COOH)=1.75×10-5,0.1mol/L 的NaF溶液与0.1mol/L 的CH3COOK溶液相比:c(Na+)-c(F-)>c(K+)-c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①中水的电离程度最小,③中水的电离程度最大 |
| B、将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
| C、将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D、将四份溶液分别稀释100倍后,溶液的pH:③>④,①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于25.3% |
| B、小于25.3% |
| C、等于25.3% |
| D、约等于25.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
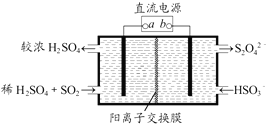
| A、a为直流电源的负极 |
| B、阴极的电极反应式为:2HSO3-+2H++e-═S2O42-+2H2O |
| C、阳极的电极反应式为:SO2+2H2O-2e-═SO42-+4H+ |
| D、电解时,H+由阴极室通过阳离子交换膜到阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜和稀硝酸反应:3Cu+8H++2NO3-═3Cu2++2NO2↑+4H2O |
| B、二氧化碳通入足量澄清石灰水中:Ca2++2OH-+CO2═CaCO3↓+H2O |
| C、铁和盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| D、氧化铜溶于足量盐酸中:O2-+2H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com