
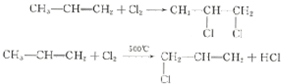
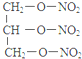 +3H2O.
+3H2O.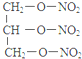 +5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO.
+5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO.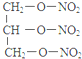 $\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2.
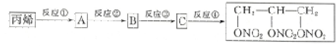
$\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2. 分析 根据各物质的转化关系,丙烯在500℃与氯气发生取代生成A为CH2=CHCH2Cl,A与氯气发生加成反应生成B为CH2ClCHClCH2Cl,B发生碱性水解得C为CH2OHCHOHCH2OH,C与硝酸发生酯化反应得三硝酸甘油酯,结合题中信息答题.
解答 解:根据各物质的转化关系,丙烯在500℃与氯气发生取代生成A为CH2=CHCH2Cl,A与氯气发生加成反应生成B为CH2ClCHClCH2Cl,B发生碱性水解得C为CH2OHCHOHCH2OH,C与硝酸发生酯化反应得三硝酸甘油酯,
(1)从丙烯合成三硝酸甘油酯的化学方程式为:反应①:CH2=CHCH3+Cl2$\stackrel{500℃}{→}$CH2=CHCH2Cl+HCl,反应②:CH2=CHCH2Cl+Cl2→CH2ClCHClCH2Cl,反应③:ClCH2CH2CH2Cl+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaCl,反应④:HOCH2CH2CH2OH+3HNO3$→_{△}^{浓H_{2}SO_{4}}$ 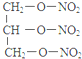 +3H2O,
+3H2O,
故答案为:CH2=CHCH3+Cl2$\stackrel{500℃}{→}$CH2=CHCH2Cl+HCl;CH2=CHCH2Cl+Cl2→CH2ClCHClCH2Cl;ClCH2CH2CH2Cl+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaCl;HOCH2CH2CH2OH+3HNO3$→_{△}^{浓H_{2}SO_{4}}$ 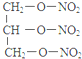 +3H2O;
+3H2O;
(2)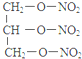 在体内酶的作用下,缓慢氧化生成CO2、H2O和NO,反应的化学方程式 为4
在体内酶的作用下,缓慢氧化生成CO2、H2O和NO,反应的化学方程式 为4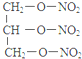 +5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO,
+5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO,
故答案为:4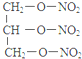 +5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO;
+5O2$\stackrel{酶}{→}$12CO2+10H2O+12NO;
(3)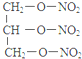 在受热或振动条件下,会急速分解并发生自身氧化还原反应,瞬时产生大量气体,发生强烈爆炸,根据电子得失守恒可知,反应的化学方程式为4
在受热或振动条件下,会急速分解并发生自身氧化还原反应,瞬时产生大量气体,发生强烈爆炸,根据电子得失守恒可知,反应的化学方程式为4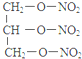 $\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2,
$\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2,
故答案为:4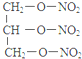 $\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2.
$\stackrel{加热或振动}{→}$12CO2+10H2O+2NO+5N2.
点评 本题考查有机物的推断与合成,侧重考查学生分析推理能力,要学会根据分子式的变化推断反应的类型,合理应用信息是解题关键,是对有机化学基础的综合考查,需要学生具备扎实的基础,难度中等.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:多选题
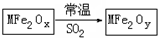 新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )| A. | x<y | B. | SO2是该反应的催化剂 | ||
| C. | MFe2Ox是还原剂 | D. | 氧化性:MFe2Oy>SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1NaHCO3溶液中:C6H5O-、K+、Na+、Cl- | |
| B. | 使甲基橙显红色的溶液中:ClO-、I-、Ca2+、Mg2+ | |
| C. | 澄清透明溶液中:Al3+、S2-、NO3-、Cu2+ | |
| D. | 0.1 mol•L-1KMnO4溶液中:H+、SO32-、SO42-、Mn2+、H2C2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
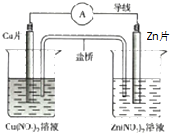
| A. | 盐桥中阴离子向正极移动 | |
| B. | 正极的电极反应是:Zn2++2e-═Zn | |
| C. | Zn片上发生氧化反应 | |
| D. | 用该电池电解水,析出3.2gCu时生成1.12LO2(标况下) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2与O3 | B. | ${\;}_{6}^{14}$C与${\;}_{6}^{12}$C | ||
| C. | CH2Cl2与CHCl3 | D. | CH3-CH2-CH2-CH3与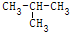 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com