
| A | A的最高价氧化物对应的水化物化学式为H2AO3 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | C原子在同周期原子中半径最大(稀有气体除外),其单质焰色为黄色 |
| D | D的基态原子最外层电子排布式为3s23p2 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
| ||
| ||


科目:高中化学 来源: 题型:
| A、在标况下,11.2L NO与11.2L O2混合后所含分子数为0.75NA |
| B、常温常压下,16g O3所含的电子数为8NA |
| C、0.1mol Na2O2晶体中含有0.4NA个离子 |
| D、铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮、磷属于同主族元素,广泛存在于生产生活的各种物质中.
氮、磷属于同主族元素,广泛存在于生产生活的各种物质中.查看答案和解析>>
科目:高中化学 来源: 题型:
 M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
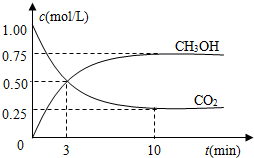 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.| n(CH3OH) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| B、向FeBr2溶液中滴加足量的氯水:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- |
| C、向40mL、8mol/L的硝酸溶液中加入5.6 g铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O |
| D、Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
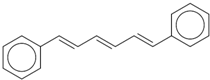 美国马丁?卡普拉等三位科学家因“在开发多尺度复杂化学系统模型”方面所做的贡献,获得了2013年诺贝尔化学奖.他们模拟出了1,6-二苯基-1,3,5-己三烯的分子模型,其结构简式如图所示.下列说法正确的是( )
美国马丁?卡普拉等三位科学家因“在开发多尺度复杂化学系统模型”方面所做的贡献,获得了2013年诺贝尔化学奖.他们模拟出了1,6-二苯基-1,3,5-己三烯的分子模型,其结构简式如图所示.下列说法正确的是( )| A、该有机物属于芳香烃,与苯互为同系物 |
| B、该有机物的分子式为C18H18 |
| C、1mol该有机物在常温下最多能与9mol Br2发生加成反应 |
| D、该有机物可以发生氧化反应、取代反应、加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
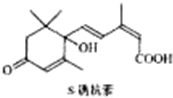 对盆栽鲜花施用S-诱抗素制剂,可以保持鲜花盛开.S-诱抗素的分子结构如图,则1mol该物质与足量的NaOH溶液反应时最多可消耗NaOH的物质的量为( )
对盆栽鲜花施用S-诱抗素制剂,可以保持鲜花盛开.S-诱抗素的分子结构如图,则1mol该物质与足量的NaOH溶液反应时最多可消耗NaOH的物质的量为( )| A、1mol | B、2mol |
| C、3mol | D、4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com