
°Њћвƒњ°њ(1)љЂ–њ∆ђЇЌ“ш∆ђ”√µЉѕяѕаЅђљю»лѕ°ЅтЋб÷–„й≥…‘≠µз≥Ў°£Є√µз≥Ў÷–ЄЇЉЂЈҐ…ъ___________Јі”¶(ћо°∞—хїѓ°±їт°∞їє‘≠°±)£ї»№“Ї÷–µƒH£Ђ“∆ѕт___________(ћо°∞’эЉЂ°±їт°∞ЄЇЉЂ°±)°£»фЄ√µз≥Ў÷–ЅљµзЉЂµƒ„№÷ Ѕњќ™60 g£ђє§„ч“їґќ ±ЉдЇу£ђ»°≥ц–њ∆ђЇЌ“ш∆ђѕіЊїЄ…‘пЇу≥∆÷Ў£ђ„№÷ ±д÷ Ѕњќ™47 g£ђ ‘Љ∆Ћг≤ъ…ъ«в∆шµƒћеїэ(±к„Љ„іњц)___ ___________°£
£®2£©ѕ÷”–Јі”¶2FeCl3£ЂCu===2FeCl2£ЂCuCl2£ђ«лЄщЊЁЄ√Јі”¶µƒ µ÷ £ђ…иЉ∆≥…‘≠µз≥Ў£ђї≠≥ц„∞÷√ЌЉ≤Ґ±к≥ц’э°ҐЄЇЉЂ≤ƒЅѕ°Ґµзљв÷ »№“Ї °£
£®3£© µ—й “÷∆±ЄFe(OH)2≥Ѕµн ±£ђ”…”Џ∆д‘Џњ’∆ш÷–ЉЂ“„ЈҐ…ъЈі”¶______________£Ѓ
£®ћоїѓ—ІЈљ≥ћ љ£©ґшЇ№ƒ—єџ≤мµљ≥Ѕµнµƒ—’…Ђ°£
ќ™÷∆µ√Fe(OH)2∞„…Ђ≥Ѕµн£ђ”–»Ћ…иЉ∆ЅЋ»з”“ЌЉЋщ Њµƒ„∞÷√£ђ”√NaOH»№“Ї°Ґћъ–Љ°Ґѕ°H2SO4µ» ‘ЉЅ÷∆±Є£Ѓ µ—й ± ‘є№Ґсјп”¶Љ”»л

£®ћо ‘ЉЅ√ы≥∆£©£Ѓ‘Џ ‘є№ҐсЇЌҐт÷–Љ”»л ‘ЉЅ£ђітњ™÷єЋЃЉ–£ђ»ыљф»ы„”Їуµƒ µ—й≤љ÷и «_______ _.
°Њір∞Є°њ£®1£©—хїѓ£ђ’эЉЂ£ђ4.48 L£ї
£®2£© £ї
£ї
£®3£©4Fe(OH)2£ЂO2£Ђ2H2O£љ4Fe(OH)3£ђѕ°H2SO4ЇЌћъ–Љ£їЉм—й ‘є№Ґт≥цњЏі¶≈≈≥цµƒH2µƒіњґ»£ђµ±≈≈≥цµƒH2“—Њ≠іњЊї ±‘ўЉ–љф÷єЋЃЉ–°£
°Њљвќц°њ
‘ћвЈ÷ќц£Ї£®1£©„№µзЉЂЈі”¶ љќ™Zn£Ђ2H£Ђ=Zn2£Ђ£ЂH2°ь£ђЄЇЉЂ «їѓЇѕЉџ…эЄя£ђЈҐ…ъ—хїѓЈі”¶£ђ–њ„чЄЇЉЂ£ђЄщЊЁ‘≠µз≥Ўµƒє§„ч‘≠јн£ђ—фјл„”ѕт’эЉЂ“∆ґѓ£ђ’эЉЂ“шµƒ÷ Ѕњ≤ї±д£ђЉх…ўµƒ «ЄЇЉЂ÷ Ѕњ£ђm(Zn)=(60£≠47)g=13g£ђ І»•µз„”µƒќп÷ µƒЅњќ™13°Ѕ2/65mol=0.4mol£ђ’эЉЂЈі”¶ љќ™2H£Ђ£Ђ2e£≠=H2°ь£ђV(H2)=0.4°Ѕ22.4/2L=4.48L£ї(2)ЄщЊЁ„№Јі”¶ љ£ђЌ≠µƒїѓЇѕЉџ…эЄя£ђЋµ√чЌ≠„цЄЇЉЂ£ђFeCl3„цµзљв÷ »№“Ї£ђ’эЉЂ≤ƒЅѕњ…“‘“шµ•÷ “≤њ…“‘ « ѓƒЂ£ђ“тіЋ„∞÷√ЌЉќ™£Ї £ї£®3£©Fe(OH)2»Ё“„±ї—х∆ш—хїѓ≥…Fe(OH)3£ђ“тіЋЈі”¶ љќ™£Ї4Fe(OH)2£ЂO2£Ђ2H2O£љ4Fe(OH)3£ђ „ѕ»≈≈≥э„∞÷√÷–њ’∆ш£ђ“тіЋI÷–Ј≈»лћъ–ЉЇЌѕ°ЅтЋб£ђ–и“™—й÷§«в∆шµƒіњґ»£ђ≤ў„ч «£ЇЉм—й ‘є№Ґт≥цњЏі¶≈≈≥цµƒH2µƒіњґ»£ђµ±≈≈≥цµƒH2“—Њ≠іњЊї ±‘ўЉ–љф÷єЋЃЉ–°£
£ї£®3£©Fe(OH)2»Ё“„±ї—х∆ш—хїѓ≥…Fe(OH)3£ђ“тіЋЈі”¶ љќ™£Ї4Fe(OH)2£ЂO2£Ђ2H2O£љ4Fe(OH)3£ђ „ѕ»≈≈≥э„∞÷√÷–њ’∆ш£ђ“тіЋI÷–Ј≈»лћъ–ЉЇЌѕ°ЅтЋб£ђ–и“™—й÷§«в∆шµƒіњґ»£ђ≤ў„ч «£ЇЉм—й ‘є№Ґт≥цњЏі¶≈≈≥цµƒH2µƒіњґ»£ђµ±≈≈≥цµƒH2“—Њ≠іњЊї ±‘ўЉ–љф÷єЋЃЉ–°£



| ƒкЉґ | Єя÷–њќ≥ћ | ƒкЉґ | ≥х÷–њќ≥ћ |
| Єя“ї | Єя“ї√вЈ—њќ≥ћЌ∆Љц£° | ≥х“ї | ≥х“ї√вЈ—њќ≥ћЌ∆Љц£° |
| Єяґю | Єяґю√вЈ—њќ≥ћЌ∆Љц£° | ≥хґю | ≥хґю√вЈ—њќ≥ћЌ∆Љц£° |
| Єя»э | Єя»э√вЈ—њќ≥ћЌ∆Љц£° | ≥х»э | ≥х»э√вЈ—њќ≥ћЌ∆Љц£° |
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ —–ЊњћЉЉ∞∆дїѓЇѕќпµƒѕаї•„™їѓґ‘ƒ№‘іµƒ≥дЈ÷јы”√°ҐµЌћЉЊ≠Љ√”–„≈÷Ў“™µƒ„ч”√°£
Ґ≈“—÷™£ЇҐўCH4(g)+H2O(g)![]() CO(g)+3H2(g) °чH1=+206.1kJ°§mol£≠1
CO(g)+3H2(g) °чH1=+206.1kJ°§mol£≠1
ҐЏ2H2(g)+CO(g)![]() CH3OH(l) °чH2=£≠128.3kJ°§mol£≠1
CH3OH(l) °чH2=£≠128.3kJ°§mol£≠1
Ґџ2H2(g)+O2(g)![]() 2H2O(g) °чH3=£≠483.6kJ°§mol£≠1
2H2O(g) °чH3=£≠483.6kJ°§mol£≠1
25°ж ±£ђ‘ЏЇѕ µƒіяїѓЉЅ„ч”√ѕ¬£ђ≤…”√Љ„ЌйЇЌ—х∆ш“ї≤љЇѕ≥…“ЇћђЉ„іЉµƒ»»їѓ—ІЈљ≥ћ љќ™ °£
Ґ∆јы”√Јі”¶Ґўјі÷∆±Є«в∆ш£ђќ™ЅЋћљЊњќ¬ґ»°Ґ—є«њґ‘Јі”¶ҐўЋў¬ °Ґ„™їѓ¬ µƒ”∞ѕм£ђƒ≥Ќђ—І…иЉ∆ЅЋ“‘ѕ¬»э„йґ‘±» µ—й(ќ¬ґ»ќ™400°жїт500°ж£ђ—є«њќ™101kPaїт404kPa)°£
µ—й–тЇ≈ | ќ¬ґ»°ж | —є«њ/kPa | CH4≥х Љ≈®ґ»/ mol°§L£≠1 | H2O≥х Љ≈®ґ»/ mol°§L£≠1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
Ґў µ—й2ЇЌ µ—й3ѕа±»£ђ∆д∆љЇв≥£ эєЎѕµ «K2 K3(ћо°∞£Њ°±°Ґ°∞£Љ°±їт°∞=°±)°£
ҐЏљЂµ»ќп÷ µƒЅњµƒCH4ЇЌЋЃ’ф∆ш≥д»л1LЇг»Ё√№±’»Ё∆ч÷–£ђЈҐ…ъ…ѕ цЈі”¶£ђ‘Џ400°жѕ¬іпµљ∆љЇв£ђ∆љЇв≥£ эK=27£ђіЋ ±»Ё∆ч÷–COќп÷ µƒЅњќ™0.10mol£ђ‘тCH4µƒ„™їѓ¬ ќ™ °£
Ґ« њ∆—ІЉ“ћб≥ц”…CO2÷∆ »° CµƒћЂ—фƒ№є§“’»зЌЉ1Ћщ Њ°£
Ґў°∞÷Ў’ыѕµЌ≥ЈҐ…ъµƒЈі”¶÷–n(FeO):n(CO2)=6:1£ђ‘тFe xOyµƒїѓ—І љќ™______________°£
ҐЏ°∞»»Ј÷љвѕµЌ≥°±÷–√њЈ÷љвl mol Fe xOy£ђ„™“∆µз„”µƒќп÷ µƒЅњќ™___________°£


ЌЉ1 ЌЉ2
Ґ»pCјаЋ∆pH£ђ «÷ЄЉЂѕ°»№“Ї÷–µƒ»№÷ ≈®ґ»µƒ≥£”√ЄЇґ‘ э÷µ°£»фƒ≥»№“Ї÷–»№÷ µƒ≈®ґ»ќ™1°Ѕ10£≠3mol°§L£≠1£ђ‘тЄ√»№“Ї÷–»№÷ µƒpC£љ£≠lg(1°Ѕ10£≠3)£љ3°£»зЌЉ2ќ™25°ж ±H2CO3»№“ЇµƒpC£≠pHЌЉ°£«лїЎірѕ¬Ѕ–ќ ћв (»фјл„”≈®ґ»–°”Џ10£≠5mol/L£ђњ…»ѕќ™Є√јл„”≤їіж‘Џ)£Ї
Ґў‘ЏЌђ“ї»№“Ї÷–£ђH2CO3°ҐHCO3£≠°ҐCO32£≠____________(ћо°∞ƒ№°±їт°∞≤їƒ№°±)іуЅњє≤іж°£
ҐЏ«уH2CO3“їЉґµзјл∆љЇв≥£ эµƒ э÷µKa1=________________°£
Ґџ»Ћће—™“Їјп÷ч“™Ќ®єэћЉЋб«в—ќїЇ≥ећеѕµ![]() њ…“‘µ÷ѕы…ўЅњЋбїтЉо£ђќђ≥÷pH=7.4°£µ±єэЅњµƒЋбљш»л—™“Ї÷– ±£ђ—™“ЇїЇ≥ећеѕµ÷–µƒ
њ…“‘µ÷ѕы…ўЅњЋбїтЉо£ђќђ≥÷pH=7.4°£µ±єэЅњµƒЋбљш»л—™“Ї÷– ±£ђ—™“ЇїЇ≥ећеѕµ÷–µƒ![]() „о÷’љЂ_________°£
„о÷’љЂ_________°£
A£Ѓ±діу B£Ѓ±д–° C£Ѓїщ±Њ≤ї±д D£ЃќёЈ®≈–ґѕ
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њѕ¬Ѕ–÷їЇђ”–C H O µƒќп÷ «£Ї£® £©
A. »йћ« B. Ѕ„÷ђ C. µнЈџ√Є D. DNA
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ»зЌЉЋщ Њ£ђ“ї√№±’»Ё∆ч±їќёƒ¶≤Ѕ°Ґњ…їђґѓµƒЅљЄф∞еaЇЌbЈ÷≥…Љ„°Ґ““Ѕљ “°£±к„Љ„іњцѕ¬£ђ‘Џ““ “÷–≥д»л1.2molHCl£ђЉ„ “÷–≥д»лNH3°ҐH2µƒїмЇѕ∆шће£ђЊ≤÷є ±їо»ыќї÷√»зѕ¬ЌЉ°£“—÷™Љ„ “÷–∆шћеµƒ÷ Ѕњ±»““ “÷–∆шћеµƒ÷ Ѕњ…ў33.8g°£

«лїЎірѕ¬Ѕ–ќ ћв£Ї
£®1£©Љ„ “÷–∆шћеµƒќп÷ µƒЅњќ™___________mol°£
£®2£©Љ„ “÷–∆шћеµƒ÷ Ѕњќ™__________g°£
£®3£©Љ„ “÷–NH3°ҐH2µƒќп÷ µƒЅњ÷Ѓ±»ќ™_____________£ђ÷ Ѕњ±»ќ™___________°£
£®4£©Њ≠єэ≤й„ Ѕѕ÷™µјHCl+NH3=NH4Cl£®NH4Cl≥£ќ¬ѕ¬ «єћће£ђЉў…иєћћеµƒћеїэњ…Їц¬‘£©£ђ»зєыљЂ∞еa»•µф£ђµ±HCl”лNH3Ќк»ЂЈі”¶Їу£ђїо»ыbљЂЊ≤÷√”Џњћґ»°∞___________°±і¶£®ћо э„÷£©
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ≥£ќ¬ѕ¬£ђѕ¬Ѕ–Єч„йјл„”‘Џ÷Єґ®»№“Ї÷–“їґ®ƒ№іуЅњє≤іжµƒ «
A£Ѓ‘Џ0.01mol°§L-1Ba£®OH£©2»№“Ї÷–£ЇAl3+°ҐNH4+°ҐNO![]() °ҐHCO
°ҐHCO![]()
B£Ѓ0.1mol/LµƒFeCl2»№“Ї÷–£ЇH+°ҐAl3+°ҐSO42-°ҐClO-
C£ЃµќЉ”KSCN»№“Їѕ‘Їм…Ђµƒ»№“Ї£ЇNH4+°ҐK+°ҐCl-°ҐI-
D£Ѓ”…ЋЃµзјл≤ъ…ъµƒc£®H+£©£љ1°Ѕ10-13mol°§L-1µƒ»№“Ї÷–£ЇNa+°ҐBa2+°ҐNO![]() °ҐCl-
°ҐCl-
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ‘Џ36gћЉ≤їЌк»Ђ»Љ…’Ћщµ√∆шће÷–£ђCO’Љ1/3ћеїэ£ђCO2’Љ2/3ћеїэ£ђ«“
C(s)+1/2(g)=CO(g) °чH=£≠110.5kJ/mol
CO(g)+1/2O2(g)=CO2(g) °чH=£≠283kJ/mol
”л’в–©ћЉЌк»Ђ»Љ…’ѕа±»£ђЋр Іµƒ»»Ѕњ «
A. 172.5kJ B. 1149kJ C. 283kJ D. 517.5kJ
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ‘Џ√№±’»Ё∆ч÷–љш––Јі”¶£ЇX£®g£©+3Y£®g£©![]() 2Z£®g£©£ђ”–єЎѕ¬Ѕ–ЌЉѕсµƒЋµЈ®’э»Јµƒ «£® £©
2Z£®g£©£ђ”–єЎѕ¬Ѕ–ЌЉѕсµƒЋµЈ®’э»Јµƒ «£® £©
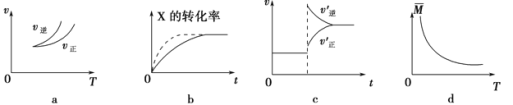
A£Ѓ“јЊЁЌЉaњ…≈–ґѕ’эЈі”¶ќ™ќь»»Јі”¶
B£Ѓ‘ЏЌЉb÷–£ђ–йѕяњ…±н Њ—є«њ‘ціу
C£Ѓ»ф’эЈі”¶µƒ¶§H£Љ0£ђЌЉcњ…±н Њ…эЄяќ¬ґ» є∆љЇвѕтƒжЈі”¶Јљѕт“∆ґѓ
D£Ѓ”…ЌЉd÷–∆шће∆љЊщѕаґ‘Ј÷„”÷ ЅњЋжќ¬ґ»µƒ±дїѓ«йњц£ђњ…Ќ∆÷™’эЈі”¶µƒ¶§H£Њ0
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њљЂ√ЊішЌґ»л ҐЈ≈‘Џ≥®њЏ»Ё∆чµƒ—ќЋбјп£ђ≤ъ…ъH2µƒЋў¬ ”л ±ЉдµƒєЎѕµњ…”…”“ЌЉЋщ Њ°£
£®1£©–і≥цјл„”Јі”¶Јљ≥ћ љ
£®2£©ѕ¬Ѕ–“тЋЎ÷–ƒ№”∞ѕмЄ√Јі”¶Ћў¬ µƒ”–£Ї £®ћо–тЇ≈£©£ї
ҐўH£Ђµƒ≈®ґ» ҐЏ√Њішµƒ±н√жїэ Ґџ»№“Їµƒќ¬ґ» Ґ№Cl-µƒ≈®ґ»°£
£®3£©љв ЌЌЉ÷–ABґќ–ќ≥…µƒ‘≠“т £ї
£®4£©љв ЌЌЉ÷–£ф1 ±њћЇуЋў¬ ±д–°µƒ‘≠“т °£
≤йњіір∞ЄЇЌљвќц>>
њ∆ƒњ£ЇЄя÷–їѓ—І јі‘і£Ї ћв–Ќ£Ї
°Њћвƒњ°њ‘Џѕ¬Ѕ–Јі”¶÷–£Ї
A£Ѓ![]()
B£Ѓ![]()
C£Ѓ![]()
D£Ѓ![]()
£®1£©ЋЃ÷ї„ч—хїѓЉЅµƒ « £®ћо–тЇ≈£ђѕ¬Ќђ£©£ђЋЃ÷ї„чїє‘≠ЉЅµƒ « £ђЋЃЉ»„ч—хїѓЉЅ”÷„чїє‘≠ЉЅµƒ « °£
£®2£©”√ЋЂѕя«≈±н ЊDЈі”¶÷–µз„”„™“∆«йњц°£
≤йњіір∞ЄЇЌљвќц>>
∞ўґ»÷¬–≈ - ЅЈѕ∞≤бЅ–±н - ‘ћвЅ–±н
Їю±± °ї•Ѕ™Ќшќ•Ј®ЇЌ≤їЅЉ–≈ѕҐЊў±®∆љћ® | Ќш…ѕ”–Ї¶–≈ѕҐЊў±®„®«ш | µз–≈’©∆≠Њў±®„®«ш | …жјъ Ј–йќё÷ч“е”–Ї¶–≈ѕҐЊў±®„®«ш | …ж∆у«÷»®Њў±®„®«ш
ќ•Ј®ЇЌ≤їЅЉ–≈ѕҐЊў±®µзї∞£Ї027-86699610 Њў±®” ѕд£Ї58377363@163.com