
| A、两种溶液中的c(Na+)相等 | ||
B、两溶液中由水电离出的c(OH-)之比为
| ||
| C、分别加水稀释到100mL时,两种溶液的pH依然相等 | ||
| D、分别与同浓度的盐酸反应,恰好反应时消耗的盐酸体积相等 |
| 10-14 |
| 10-9 |
| 10-9 |
| 10-5 |


科目:高中化学 来源: 题型:
| 转化的甲醇的物质的量 |
| 催化剂的物质的量 |
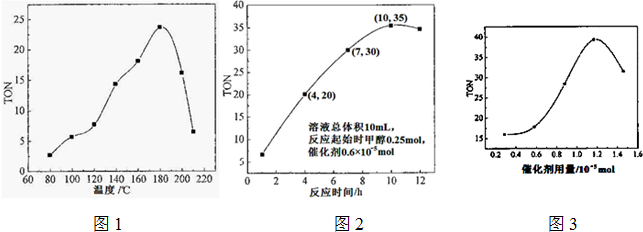
| H2CO3 |
| HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
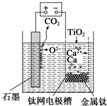 如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质.图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛.下列说法不正确的是( )
如图,石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质.图示装置工作时,生成的金属钙能还原二氧化钛制备金属钛.下列说法不正确的是( )| A、阳极反应式为C+2O2--4e-═CO2↑ |
| B、由TiO2制得1mol金属Ti,理论上外电路转移4mol电子 |
| C、制备金属钛前后,装置中CaO的量不变 |
| D、TiO2在阴极放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | ||||
B、用石墨电极电解氯化镁溶液:2Cl-+2H2O
| ||||
| C、向CaCl2溶液中通入CO2气体:Ca2++CO2+H2O═CaCO3↓+2H+ | ||||
| D、等物质的量浓度的小苏打溶液和石灰水按体积比3:2混合:3HCO3-+2Ca2++3OH-═2CaCO3↓+CO32-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、所谓低碳经济,是指在可持续发展理念指导下,尽可能地减少光化学污染气体的排放 |
| B、汽油、柴油和植物油都是碳氢化合物 |
| C、只由一种元素组成的物质,一定是纯净物 |
| D、化学反应的实质就是旧化学键的断裂、新化学键形成过程 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L CH3CHO中含有的分子数为NA |
| B、pH=1的稀硫酸中含有的H+数为0.1NA |
| C、7.80g Na2O2与5.85g NaCl所含阴离子数相等 |
| D、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水中滴入酚酞溶液,溶液变红:NH3?H2O═NH4++OH- |
| B、90℃时,测得纯水中c(H+)?c(OH-)=3.8×10-13:H2O(l)?H+(aq)+OH-(aq)△H<0 |
| C、FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ |
| D、向苯酚钠溶液中通入CO2,溶液变浑浊:2C6H5ONa+CO2+H2O→2C6H5OH+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
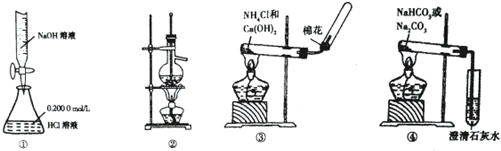
| A、用图①所示装置测定NaOH的浓度 |
| B、用图②所示装置分馏少量石油 |
| C、用图③所示装置在实验室制备收集氨气 |
| D、用图④所示装置鉴别碳酸钠和碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验目的 | |
| A | 将SO2通入酸性KMnO4溶液中,紫色褪去 | 证明SO2具有漂白性 |
| B | 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色褪去 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 证明氧化性:Cu2+>Fe3+ |
| D | 向Na2SiO3溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com