
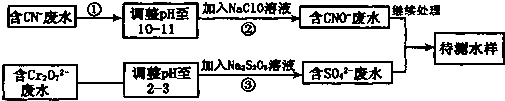
2- 7 |
2- 7 |
2- 7 |
| 2 |
| 2-x |
| 2(1+x) |
| 2-x |
| 2 |
| 2-x |


 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
| A、物质的量比为1:1 |
| B、密度比为11:1 |
| C、质量比为1:22 |
| D、质子数比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
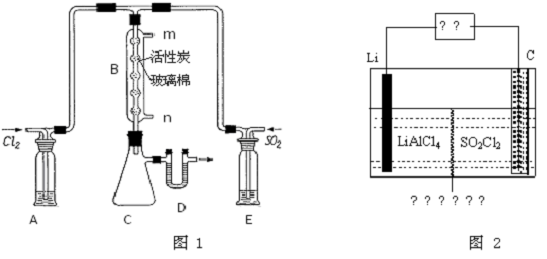
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三者对应的氧化物均为酸性氧化物 |
| B、三者的单质直接与氧气反应都能生成两种以上氧化物 |
| C、同温度、同浓度的Na2CO3、NaNO3、Na2SO3溶液的pH:NaNO3<Na2SO3<Na2CO3 |
| D、CO2、NO2、SO2都能与H2O反应,其反应原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
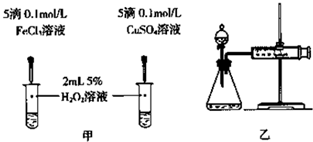
查看答案和解析>>
科目:高中化学 来源: 题型:
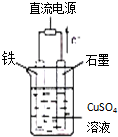 (1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池:用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气.写出负极的电极反应式
(1)已知298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水,利用该反应设计一个燃料电池:用氢氧化钾溶液做电解质溶液,用多孔石墨做电极,在电极上分别充入乙烷和氧气.写出负极的电极反应式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com