
某探究学习小组用下图所示装置进行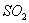 、
、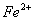 和
和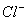 还原性强弱比较实验,实验过程如下:
还原性强弱比较实验,实验过程如下:
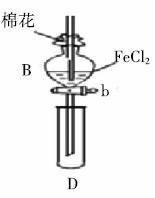
I. 先向B中的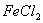 溶液(约
溶液(约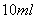 )中通入
)中通入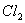 ,当B的溶液变黄时,停止通气。
,当B的溶液变黄时,停止通气。
II. 打开活塞b,使约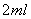 的溶液流入D试管中,检验取出溶液中的离子。
的溶液流入D试管中,检验取出溶液中的离子。
III. 接着再向B中通入一定量的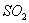 气体。
气体。
IV. 更新试管D,重复过程II,检验取出溶液中的离子。
(1)仪器B的名称是__________,棉花中浸润的溶液为__________,目的是__________。
(2)实验室制备氯气的化学方程式为__________。
(3)过程III中一定发生反应的离子方程式为__________,过程IV中检验取出溶液中是否含有硫酸根的操作是____________________。
(4)该小组对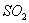 、
、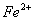 和
和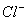 还原性强弱比较期望达到的结论是:______________。
还原性强弱比较期望达到的结论是:______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明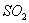 、
、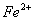 和
和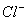 还原性强弱关系的是____________________。
还原性强弱关系的是____________________。
| 过程II中检出离子 | 过程IV中检出离子 | |
| 甲 | 有 | 有 |
| 乙 | 既有 | 有 |
| 丙 | 有 | 有 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)合成氨反应反应N2(g)+3H2(g)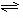 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”“向右”或“不”);,使用催化剂 反应的ΔH(填“增大”“减小”或“不改变”)
(2)O2 (g)= O+2(g)+e-  H1= 1175.7 kJ·mol-1
H1= 1175.7 kJ·mol-1
PtF6(g)+ e-1 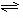 PtF6-(g)
PtF6-(g)  H2= - 771.1 kJ·mol-1
H2= - 771.1 kJ·mol-1
O2+PtF6-(s)=O2+(g)+PtF6-  H3=482.2 kJ·mol-1
H3=482.2 kJ·mol-1
则反应O2(g)+ PtF6 (g) = O2+PtF6- (s)的 H=_____________ kJ·mol-1。
H=_____________ kJ·mol-1。
(3)在25℃下,向浓度均为0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×12-11,KsP[Cu(OH)2]=2.2×12-20。
(4)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4*)=c( ),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________
),则溶液显_____________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下,对于反应2A(g)+B(g)  2C(g),下列说法中正确的是
2C(g),下列说法中正确的是
A.此反应的平衡常数K= 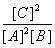
B.改变条件该反应的平衡常数K一定不变
C.改变压强并加入催化剂,平衡常数会随之变化
D.平衡时增大A和B的浓度,平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H 2C2O4 + 3H2SO4 === K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/ mL | 溶液褪至无色所需时间/ min | |||
| 0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | |||
| 1 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 20 | 3.0 | m | 2.5 | n | 4.8 |
| 3 | 20 | 3.0 | 3.0 | 2.0 | 2.0 | t1 |
| 4 | 30 | 3.0 | 2.0 | 3.0 | 2.0 | t2 |
(1)已知:实验1、2、3的目的是探究KMnO4浓度对反应速率的影响。则实验2中m= ,
n= 。如果研究温度对化学反应速率的影响,需利用实验4和 。
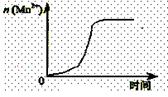 (2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如右图所示。为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用。
(2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如右图所示。为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用。
①请你填写表中空白帮助该小组同学完成实验方案。
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 溶液褪至无色所需时间/ min | |||
| 0.6 mol/L | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L | ||||
| 5 | 20 | 3.0 | 2.0 | 3.0 | 2.0 |
| t3 |
②能说明该小组同学提出的假设成立的实验事实是 。
(3)有人将酸性KMnO4 溶液和H 2C2O4 溶液的反应设计成原电池,则该原电池的正极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中有关微粒的物质的量浓度关系不正确的是( )
A. 物质的量浓度相等的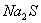 和
和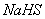 混合溶液中:
混合溶液中:
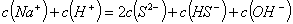
B. 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
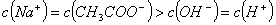
C. 常温下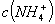 相等的①
相等的①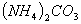 、②
、②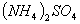 、③
、③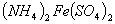 三种溶液中,溶质的物质的量浓度大小:①>②>③
三种溶液中,溶质的物质的量浓度大小:①>②>③
D. 等体积、等物质的量浓度的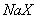 和弱酸
和弱酸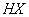 混合后呈酸性的溶液中:
混合后呈酸性的溶液中:
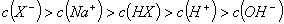
查看答案和解析>>
科目:高中化学 来源: 题型:
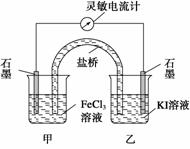
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是( )
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上的Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
在固定容积的密闭容器中,可逆反应2X(?)+Y(g) Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是( )
Z(s)已达到平衡,此时升高温度则气体的密度增大。下列叙述正确的是( )
A.正反应为放热反应,X可能是气态、液态或固态 B.正反应为放热反应,X一定为气态
C.若X为非气态,则正反应为吸热反应 D.若加入少量的Z,该平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表示各物质之间的转化关系。已 知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元
知D、E、Z是中学化学常见的单质,其他都是化合物。Z、Y是氯碱工业的产品。D元 素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。
素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂。E为日常生活中应用最广泛的金属。除反应①外,其他反应均在水溶液中进行。请回答下列问题。
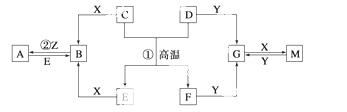
(1)写出下列物质的化学式:B___ _________、G___________________、Y______________。
_________、G___________________、Y______________。
(2)在电镀工业中,若将E作为待镀金属,铜为镀层金属,则E是__________极,请写出在此电极上发生的电极反应式: ________________。
(3)写出反应①的化学方程式___________。
(4)A溶液与NaOH溶液混合可形成沉淀,某温度下此沉淀的Ksp=2.097×10-39。将
0.01 mol·L-1的A溶液与0.001 mol·L-1的NaOH溶液等体积混合,你认为能否形成沉淀_______(填“能”或“不能”),请通过计算说明_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63 g ②(a+b)×189 g ③(a+b)mol ④(Vc-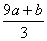 )mol
)mol
A.①④ B.②③
C.①③ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com