
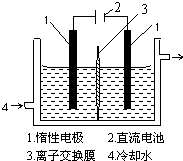
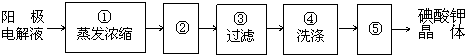
 在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.
在全民补碘政策实施了15年之久的今天,有媒体报道称,一些地区的临床医生反映甲状腺疾病发病呈上升趋势,于是一些专家呼吁,停止对食盐进行国家的强制加碘,应该根据不同地区的实际情况来决定是否应该加碘.食盐加碘剂主要成份是碘酸钾(KIO3).工业上可用碘为原料通过电解制备碘酸钾.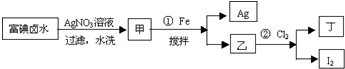


科目:高中化学 来源: 题型:
| A、在常温下可用铝制容器贮藏运输浓硫酸 |
| B、单质硅可用于制造光纤和太阳能电池 |
| C、二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| D、氢氧化钠用于治疗胃溃疡病人的胃酸过多症 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下的可逆反应,只有达到平衡时才具有平衡常数 |
| B、改变外界条件使化学平衡状态改变时,平衡常数也一定改变 |
| C、对于一个确定的反应来说,平衡常数的数值越大,反应限度越大 |
| D、对于反应2NO2(g)?N2O4(g)正反应的平衡常数为K1,逆反应的平衡常数为K2,K1=K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将一定量KAl(SO4)2溶液和一定量Ba(OH)2溶液混合,沉淀的质量恰好最大时:Al3++2SO42-+3OH-+2Ba2+=2BaSO4↓+Al(OH)3↓ |
| B、KMnO4与浓盐酸反应制Cl2:2MnO4-+16HCl=2Mn2++6Cl-+5Cl2↑+8H2O |
| C、0.1 mol Cl2和100 mL 1 mol/L FeBr2反应:3Cl2+2Fe2++4Br -=6Cl-+2Fe3++2Br2 |
| D、用Al(OH)3中和过多的胃酸:Al(OH)3+3H+=Al3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ② |
| ① |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com