
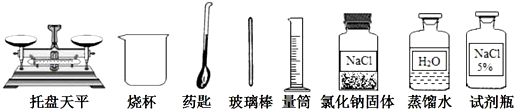
分析 (1)依据配制一定质量分数溶液时,溶解操作判断玻璃棒作用;
依据溶质的质量=溶液的质量×质量百分数;
(2)分析操作对溶质的质量和溶液质量的影响,根据溶质的质量分数=$\frac{溶质的质量}{溶液的质量}$×100%进行误差分析;
(3)泡菜中含有硝酸盐在发酵过程中会发生缓慢氧化反应生成亚硝酸盐.
解答 解;(1)配制 50 克15%的氯化钠溶液,称取的固体应放在烧杯中溶解,为加快溶解速率,应用玻璃棒搅拌;
配制 50 克15%的氯化钠溶液,应称取氯化钠质量m=50g×15%=7.5g;
故答案为:搅拌,加速固体溶解;7.5;
(2)①称量时,天平指针左偏,导致称取的溶质的质量偏大,溶质的质量分数偏大,故不选;
②量取水时仰视读数,导致量取的溶剂数的体积偏大,溶液质量偏大,溶液的质量分数偏小,故选;
③溶解时未用玻璃棒搅拌,会影响溶解的速率,而不会影响溶质的质量分数,故不选;
④溶液具有均一性,所以装瓶时,有部分溶液洒出,溶液浓度不大,溶质的质量分数不变,故不选;
故选:②;
(3)泡菜中含有硝酸盐在发酵过程中会发生缓慢氧化反应生成亚硝酸盐,所以该过程属于缓慢氧化;
故答案为:属于;
点评 本题考查了配制一定质量分数浓度溶液,明确配制原理及操作过程是解题关键,注意误差分析的方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
 已知NaCl的摩尔质量为Mg•mol-1,晶体的密度为d g•cm-3,如图中Na+与最邻近的Cl-的核间距离为x cm,那么阿伏加德罗常数的值可表示为( )
已知NaCl的摩尔质量为Mg•mol-1,晶体的密度为d g•cm-3,如图中Na+与最邻近的Cl-的核间距离为x cm,那么阿伏加德罗常数的值可表示为( )| A. | 2Mx3d | B. | $\frac{M}{(2{x}^{3}d)}$ | C. | $\frac{4M}{({x}^{3}d)}$ | D. | $\frac{M}{({N}_{A}{x}^{3})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的颜色随核电荷数的增加而加深 | |
| B. | 单质的熔、沸点随核电荷数的增加而升高 | |
| C. | 它们的氢化物的还原性随核电荷数的增加而增强 | |
| D. | 它们的氢化物的稳定性随核电荷数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

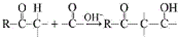
 用系统命名法命名,它的名称是1,3-丙二硫醇;反应B→C,实际上可看作两步进行,依次发生的反应类型是加成反应、消去反应.
用系统命名法命名,它的名称是1,3-丙二硫醇;反应B→C,实际上可看作两步进行,依次发生的反应类型是加成反应、消去反应.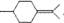 ,则异蒲勒醇的结构简式为:
,则异蒲勒醇的结构简式为: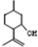 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无水酒精洗手机屏幕 | B. | 食醋洗去水壶内的水垢 | ||
| C. | 清水洗涤衣服上的食盐 | D. | 汽油洗涤衣服上的油迹 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素的最外层电子数等于元素的最高化合价 | |
| C. | 原子序数越大,原子半径越大 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
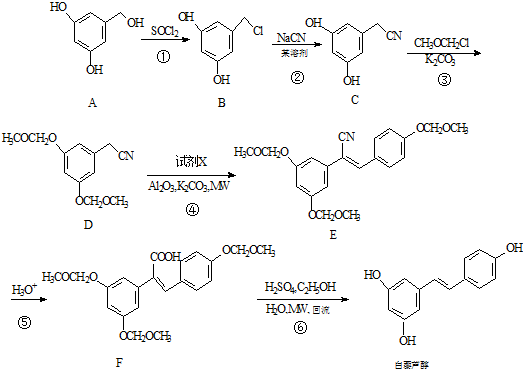
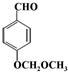 .
.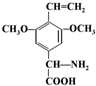 或
或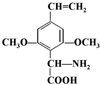 .(任写一种)
.(任写一种)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com